
分析 (1)根據蓋斯定律求出4CO(g)+2NO2(g)=N2(g)+4CO2(g)的反應熱,反應中3.36LCO即0.15mol轉移0.3mol電子,根據物質的量之比等于熱量比求出放出的熱量;
(2)已知①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
將方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=△H1+△H2,結合1molCH4還原NO2至N2的整個過程中放出的熱量為867kJ計算.
解答 解:(1)①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ•mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ•mol-1(b>0)
將方程式①×2+②得4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a) KJ•mol-1×2+(-b KJ•mol-1)=-(2a+b)KJ•mol-1
所以其熱化學反應方程式為:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=-(2a+b)KJ•mol-1,
根據方程式知轉移電子的物質的量=$\frac{3.36L}{22.4L/mol}$×2=0.3mol,放出的熱量=$\frac{3.36L}{22.4L/mol}$×$\frac{(2a+b)kJ/mol}{4}$=$\frac{3(2a+b)}{80}$kJ,
故答案為:0.3;$\frac{3(2a+b)}{80}$;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
將方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=△H1+△H2,
根據方程式知,1mol CH4還原NO2至N2整個過程中放出的熱量為867KJ,所以△H2=-867KJ/mol×2-(-574KJ/mol)=-1160KJ/mol,
故答案為:-1160KJ/mol.
點評 本題考查了蓋斯定律的有關計算,會利用蓋斯定律書寫出反應物之間的關系式是解本題關鍵,難度中等.


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在一個多電子原子中,不可能有兩個運動狀態完全相同的電子 | |
| B. | 在一個多電子原子中,不可能有兩個能量相同的電子 | |
| C. | 在一個多電子原子中,N層上的電子能量肯定比M層上的電子能量高 | |
| D. | 某個多電子原子的3p能級上僅有兩個電子,它們的自旋狀態必然相反 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol聚乙烯含有的原子數目為6NA | |
| B. | 標準狀況下,11.2L CHCl3中所含有的原子總數為2.5NA | |
| C. | 一定條件下,2.6 g乙炔、苯的氣態混合物中所含碳原子數為0.2NA | |
| D. | 1 mol甲基與1mol羥基所含電子數均為10 NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 視黃醛的分子式為C21H26O | |
| B. | 維生素A分子結構中含有苯環、碳碳雙鍵和羥基 | |
| C. | 視黃醛是維生素A的氧化產物 | |
| D. | 1 mol甲和1 mol乙在一定條件下均最多能與6 mol H2發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
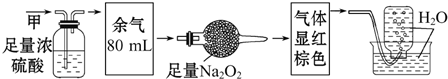
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

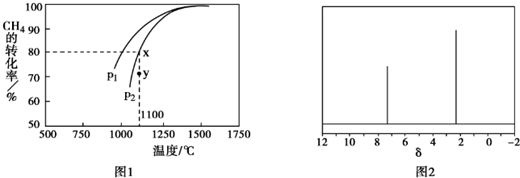
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com