
分析 (1)硫酸的物質(zhì)的量n=$\frac{m}{M}$;1mol硫酸中含4mol氧原子,根據(jù)m=nM來計算;
(2)根據(jù)同溫同壓下,同體積的氣體的物質(zhì)的量相同,根據(jù)氫氣的質(zhì)量求出其物質(zhì)的量n=$\frac{m}{M}$,即可得出A的物質(zhì)的量,然后根據(jù)摩爾質(zhì)量M=$\frac{m}{n}$來計算;
(3)設(shè)混合氣體中CO的物質(zhì)的量為xmol,二氧化碳的物質(zhì)的量為ymol,根據(jù)質(zhì)量列式可得:28x+44y=10.8 ①
根據(jù)物質(zhì)的量列式可得:x+y=0.3 ②
解①②可得x、y.
解答 解:(1)49g硫酸的物質(zhì)的量n=$\frac{m}{M}$=$\frac{49g}{98g/mol}$=0.5mol;由于1mol硫酸中含4mol氧原子,故0.5mol硫酸中含2mol氧原子,質(zhì)量m=nM=2mol×16g/mol=32g,故答案為:0.5mol,32g;
(2)同溫同壓下,同體積的A氣體和氫氣的物質(zhì)的量相同,0.2g氫氣的物質(zhì)的量n=$\frac{m}{M}$=$\frac{0.2g}{2g/mol}$=0.1mol,故氣體A的物質(zhì)的量也為0.1mol,故A的摩爾質(zhì)量M=$\frac{m}{n}$=$\frac{4.8g}{0.1mol}$=48g/mol,故答案為:48g/mol,1:1;
(3)設(shè)混合氣體中CO的物質(zhì)的量為xmol,二氧化碳的物質(zhì)的量為ymol,根據(jù)質(zhì)量列式可得:28x+44y=10.8 ①
根據(jù)物質(zhì)的量列式可得:x+y=0.3 ②
解①②可得:x=0.15mol,y=0.15mol.
故CO的質(zhì)量分?jǐn)?shù)=$\frac{0.15mol×28g/mol}{10.8g}×100%$=38.9%
故答案為:0.15mol,38.9%.
點(diǎn)評 考查阿伏伽德羅定律及推論、常用化學(xué)計量的有關(guān)計算,難度不大,可以借助pV=nRT理解阿伏伽德羅定律及推論.



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 加入鋁粉能產(chǎn)生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反應(yīng)的離子方程式為SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃時NH4Cl溶液的KW大于100℃時NaCl溶液的KW | |
| D. | 100℃時,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合,溶液顯中性 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
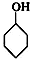 ⑥
⑥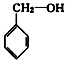 ⑦
⑦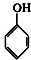
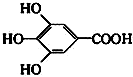
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:多選題
| 甲 | 乙 | |
| A | 物質(zhì)A的分子數(shù) | 一個A分子的質(zhì)量 |
| B | 標(biāo)準(zhǔn)狀況下氣體摩爾體積 | 標(biāo)準(zhǔn)狀況下氣體體積 |
| C | 固體體積 | 固體密度 |
| D | 非標(biāo)準(zhǔn)狀況下物質(zhì)的質(zhì)量 | 物質(zhì)的摩爾質(zhì)量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
 Cu2S是火法煉銅的重要原料之一,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:
Cu2S是火法煉銅的重要原料之一,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 阿司匹林可由水楊酸與乙酸酐作用制得.其制備原理如下:
阿司匹林可由水楊酸與乙酸酐作用制得.其制備原理如下:

 ;
;查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com