

 .
. .
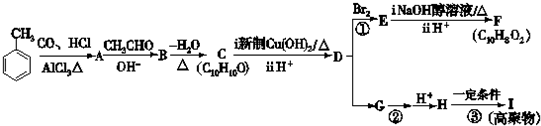
. 分析 E的相對分子質量為102,其中碳、氫兩種元素的質量分數分別為58.8%、9.8%,則碳、氫、氧的原子個數比=$\frac{58.8%}{12}$:$\frac{9.8%}{1}$:$\frac{1-58.8%-9.8%}{16}$=5:10:2,則E的分子式為C5H10O2;E為無支鏈的化合物,并且含有5個C原子,由C和D反應生成,C能和碳酸氫鈉反應,則C為羧酸,D為醇,二者共含5個C原子,并且C和D的相對分子質量相等,應為乙酸和丙醇,E無支鏈,D應為1-丙醇,二者發生酯化反應生成酯E;A是由B與乙酸、丙醇發生酯化反應后生成的產物,其結構簡式為: ,據此答題;
,據此答題;
解答 解:E的相對分子質量為102,其中碳、氫兩種元素的質量分數分別為58.8%、9.8%,則碳、氫、氧的原子個數比=$\frac{58.8%}{12}$:$\frac{9.8%}{1}$:$\frac{1-58.8%-9.8%}{16}$=5:10:2,則E的分子式為C5H10O2;E為無支鏈的化合物,并且含有5個C原子,由C和D反應生成,C能和碳酸氫鈉反應,則C為羧酸,D為醇,二者共含5個C原子,并且C和D的相對分子質量相等,應為乙酸和丙醇,E無支鏈,D應為1-丙醇,二者發生酯化反應生成酯E;A是由B與乙酸、丙醇發生酯化反應后生成的產物,其結構簡式為: ,
,
(1)通過以上分析知,C是乙酸,所以C含有羧基,B中含有羧基、醇羥基和苯環,且連接醇羥基碳原子相鄰的碳原子上有氫離子,所以B能發生加成、取代、酯化、消去、置換等反應,不能發生水解反應;
故答案為:羧基;e;
(2)②為乙酸和丙醇的酯化反應,反應方程式為:CH3COOH+CH3CH2CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH2CH3+H2O,
故答案為:CH3COOH+CH3CH2CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH2CH3+H2O;
(3)該反應較緩慢,為加快反應速率,所以加熱,且加熱能及時將產物乙酸丙酯蒸出,有利于平衡向正反應方向移動,所以反應②實驗中加熱,
故答案為:加快反應速率;及時將產物乙酸丙酯蒸出,以利于平衡向生成乙酸丙酯的方向移動;
(4)通過以上分析知,A的結構簡式為 ;
;
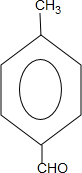
(5)符合條件的B的同分異構體中,含有兩個取代基、其中一個是羥基,并且是由乙酸、丙酸或甲酸分別與對應的芳香醇或酚酯化反應生成的酯類物質,可判斷出符合條件的有4種,分別為 ,
,
故答案為: .
.
點評 本題考查有機物的合成與推斷,并考查鹽類的水解等知識,結合反應條件與轉化判斷其結構是解題的關鍵,做該類型題目時注意挖掘題目中的關鍵信息,采用正推或逆推的方式逐一突破,難度較大.


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子中N-C-N鍵角為90° | |
| B. | C(N3)4中碳元素為正價,C(N3)4分子中存在極性鍵和非極性鍵 | |
| C. | C(N3)4就是石墨吸附N2后所得的物質 | |
| D. | 該物質為分子晶體,每18g C(N3)4完全分解可產生13.44L的氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ClO2的分子結構呈V型,屬非極性分子 | |
| B. | ClO2中氯元素顯+4價,具有很強的氧化性,其消毒效率(以單位體積得電子的數目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于環境消毒,具有廣譜高效的特點,對人畜無任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性條件下,還原NaClO3來制ClO2,這一反應的化學方程式可表示為Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將一小塊試紙放在表面皿上,用玻璃棒蘸取少量待測液點在試紙上,再與標準比色卡對照 | |
| B. | 不能使無色酚酞試液變色的溶液是酸性溶液 | |
| C. | 可以用紫色石蕊試液作為強酸滴定強堿的指示劑 | |
| D. | 用pH試紙測定某溶液的pH=8.5,此溶液一定是某種堿的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在此反應中硝酸體現強氧化性,全部被還原 | |
| B. | 向反應后的溶液中再加入金屬鐵,不再發生化學反應 | |
| C. | 該反應中被還原的硝酸與未被還原的硝酸之比為1:4 | |
| D. | 該反應中被還原的硝酸與未被還原的硝酸之比為1:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
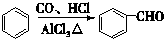
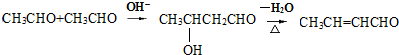
 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$ +nH2O.
+nH2O. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com