
| A. | 在此反應中硝酸體現強氧化性,全部被還原 | |
| B. | 向反應后的溶液中再加入金屬鐵,不再發生化學反應 | |
| C. | 該反應中被還原的硝酸與未被還原的硝酸之比為1:4 | |
| D. | 該反應中被還原的硝酸與未被還原的硝酸之比為1:5 |
分析 物質的量之比為1:3的鋅與稀硝酸反應,設Zn的物質的量為1mol則硝酸的物質的量為3mol,若硝酸被還原的產物為N2O,反應結束后鋅沒有剩余,鋅完全溶解轉移電子物質的量=1mol×(2-0)=2mol,根據轉移電子相等生成n(N2O)=$\frac{2mol}{(5-1)×2}$=0.25mol,根據N原子守恒得作氧化劑硝酸的物質的量=2n(N2O)=2×0.25mol=0.5mol,起酸作用硝酸物質的量=2n[Zn(NO3)2]=2×1mol=2mol,所以消耗總的硝酸物質的量=0.5mol+2mol=2.5mol<3mol,則硝酸有剩余,據此分析解答.
解答 解:物質的量之比為1:3的鋅與稀硝酸反應,設Zn的物質的量為1mol則硝酸的物質的量為3mol,若硝酸被還原的產物為N2O,反應結束后鋅沒有剩余,鋅完全溶解轉移電子物質的量=1mol×(2-0)=2mol,根據轉移電子相等生成n(N2O)=$\frac{2mol}{(5-1)×2}$=0.25mol,根據N原子守恒得作氧化劑硝酸的物質的量=2n(N2O)=2×0.25mol=0.5mol,起酸作用硝酸物質的量=2n[Zn(NO3)2]=2×1mol=2mol,所以消耗總的硝酸物質的量=0.5mol+2mol=2.5mol<3mol,則硝酸有剩余,
A.根據以上分析知,在此反應中硝酸體現強氧化性、酸性,部分被還原,故A錯誤;
B.硝酸有剩余,所以向反應后的溶液中再加入金屬鐵,會發生化學反應,故B錯誤;
C.被還原硝酸的物質的量是0.5mol,未被還原硝酸的物質的量=3mol-0.5mol=2.5mol,所以該反應中被還原的硝酸與未被還原的硝酸之比=0.5mol:2.5mol=1:5,故C錯誤;
D.根據C知,該反應中被還原的硝酸與未被還原的硝酸之比為1:5,故D正確;
故選D.
點評 本題以鋅和稀硝酸的反應為載體考查氧化還原反應方程式的有關計算,正確判斷溶液中的溶質是解本題關鍵,易錯選項是CD,注意未被還原的硝酸還包含沒有反應的硝酸,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題

 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 澄清石灰水、濃H2SO4 | B. | KMnO4(H+)、濃H2SO4 | ||
| C. | 溴水、NaOH溶液、濃H2SO4 | D. | 濃H2SO4、KMnO4(H+)、NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 有關信息 |
| A | 其氫化物水溶液呈堿性 |
| B | 地殼中含量最多的元素 |
| C | 單質須保存在煤油中 |
| D | 單質與NaOH溶液反應可用于生產漂白液 |
| E | 單質是生活中用量最大的金屬,其制品在潮濕空氣中易被腐蝕或損壞 |
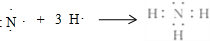 .寫出實驗室制取該物質的化學方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.寫出實驗室制取該物質的化學方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 我國發射的“嫦娥三號”衛星中使用的碳纖維,是一種新型無機非金屬材料 | |
| B. | 只要符合限量,“食用色素”“碘元素”、“亞硝酸鹽”可以作為某些食品的添加劑 | |
| C. | 氫氧化鐵溶膠、水玻璃、淀粉溶液均具有丁達爾效應 | |
| D. | “地溝油”經過加工處理后,可以用來制肥皂和生物柴油 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com