
| 難溶電解質 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
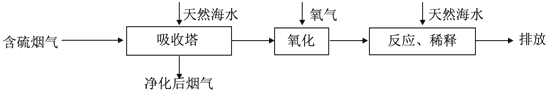
分析 I.(1)海水中的弱酸根離子水解顯堿性;
(2)H2SO3或HSO3-中的S顯+4價,均可被O2氧化生成H+、SO42-,酸性會大大增強,氧化后的“海水”需要引入大量的顯堿性的海水與之混合后才能排放,主要目的是中和、稀釋經氧氣氧化后海水中生成的酸(H+);
II.(3)溶度積越小越易轉化為沉淀,根據表格中的數據進行判斷最近試劑;
(4)先計算出溶液中氫氧根離子的物質的量濃度,然后根據Pb(OH)2的溶度積及c(Pb2+)=$\frac{{K}_{sp}}{{C}^{2}(O{H}^{-})}$進行計算;
(5)根據氯化銀的溶度積進行解答,并與排放標準對比來說明是否符合排放標準.
解答 解:I.(1)海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等離子,在這些離子中能發生水解的是CO32-、HCO-3離子,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-它們水解呈堿性,所以天然海水的pH≈8,呈弱堿性,
故答案為:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
(2)天然海水吸收了含硫煙氣后,要用O2進行氧化處理,氧氣將H2SO3氧化為硫酸,該反應為2H2SO3+O2=2H2SO4,氧化后的“海水”需要用大量的天然海水與之混合后才能排放,是因中和稀釋經氧氣氧化后海水中生成的酸(H+),
故答案為:2H2SO3+O2=2H2SO4;中和、稀釋經氧氣氧化后海水中生成的酸;
II.(3)溶度積越小的越易轉化為沉淀,由表格中的數據可知,硫化物的溶度積小,則應選擇硫化鈉,故答案為:B;
(4)由Pb(OH)2的溶度積為1.2×10-15,pH=8.0,c(OH-)=10-6mol•L-1,則c(Pb2+)=$\frac{{K}_{sp}}{{C}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-15}}{(1{0}^{-6})^{2}}$=1.2×10-3mol•L-1,
故答案為:1.2×10-3mol•L-1;
(5)廢水中NaCl的質量分數為0.117%(ρ≈1g•mL-1),c(Cl-)=c(NaCl)=$\frac{1000×1g/mL×0.117%}{58.5g/mol}$=0.02mol/L,
Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10mol2•L-2,則c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.02}$=9×10-9mol•L-1,環境要求排放標準為c(Ag+)低于1.0×10-8mol•L-1,顯然9×10-9mol•L-1<1.0×l0-8mol•L-1,則符合排放標準,
故答案為:9×10-9mol•L-1;是.
點評 本題考查了海水中資源的綜合應用、含硫煙氣的處理及難溶物的沉淀轉化,側重于考查學生對基礎知識的綜合應用能力,注意把握Ksp的有關計算的方法,題目難度中等.


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化銅與鹽酸、氫氧化鋇與鹽酸 | |
| B. | 石灰石和硝酸溶液、石灰石與鹽酸溶液 | |
| C. | BaCO3與HCl溶液、Na2CO3溶液NaHSO4 | |
| D. | 石灰水中通CO2、石灰水中通SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀釋濃硫酸時,應將蒸餾水沿玻璃棒緩慢注入濃硫酸中 | |
| B. | 配制溶液時,若加水超過容量瓶刻度,應用膠頭滴管將多余溶液吸出 | |
| C. | 蒸餾時蒸餾燒瓶中液體的體積不能超過其容積的規格,液體也不能蒸干 | |
| D. | 檢驗某溶液是否含有SO42-時,應取少量該溶液,依次加入BaCl2溶液和稀鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質名稱 | 葡萄糖酸鈣 | 葡萄糖酸 | 溴化鈣 | 氯化鈣 |
| 水中的溶解性 | 可溶于冷水 易溶于熱水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醬油中添加含鐵的營養強化劑 | B. | 飲料中添加塑化劑 | ||
| C. | 用甲醛浸泡海鮮 | D. | 用工業鹽腌制臘肉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋰錳電池的體積小、性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4.溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2.回答:
鋰錳電池的體積小、性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4.溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2.回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 LCCl4含有的分子數為NA個 | |
| B. | 500mL 1moL/L的鹽酸溶液中含有的HCl分子數為0.5 NA個 | |
| C. | 將1L 2 mol/L的FeCl3溶液制成膠體后,其中含有氫氧化鐵膠粒數為2NA個 | |
| D. | 23gNa與O2反應生成Na2O和Na2O2的混合物,轉移的電子數為 NA個 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com