
| 物質 | H2 | CO | CH3OH |
| 濃度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

分析 (1)該反應正反應為放熱反應,應選擇催化活性高、速度快、反應溫度較低;
(2)①計算此時的濃度商Qc,與平衡常數比較,判斷反應進行的方向,進而判斷正、逆反應速率的相對大小;
②與表中數據相比,根據氫氣濃度變化量計算甲醇的濃度變化量,進而計算平衡時甲醇的濃度,再根據v=$\frac{△c}{△t}$計算v(CH3OH);
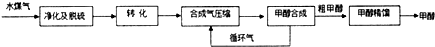
(3)合成氣進行循環,可以提高原料利用率及生成物的產率;
(4)原電池中失電子的為負極;正極上ClO-得電子生成氯離子;
(5)①N電極上HOOC-COOH得電子,再氫離子參與反應條件下生成HOOC-CHO;
②2mol H+通過質子交換膜,則電池中轉移2mol電子,N極電極反應式為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,M極電極反應式為:OHC-CHO-2e-+H2O═HOOC-CHO+2H+,兩極均有乙醛酸,再結合電極方程式計算.
解答 解:(1)該反應正反應為放熱反應,應選擇催化活性高、速度快、反應溫度較低,故選擇Z,
故答案為:Z;催化活性高、速度快、反應溫度較低;
(2)①由表中數據可知,10min時氫氣的濃度為0.2mol/L、CO的濃度為0.1mol/L、甲醇的濃度為0.4mol/L,則此時的濃度商Qc=$\frac{0.4}{0.{2}^{2}×0.1}$=100,小于平衡常數160,故反應向正反應方向進行,故V正>V逆,故答案為:>;
②若加入同樣多的CO、H2,在T5℃反應,10 min后達到平衡,此時c(H2)=0.4 mol•L-1,與表中數據相比,可知氫氣的濃度變化量為0.4mol/L-0.2mol/L=0.2mol/L,故甲醇的濃度變化量為0.2mol/L×$\frac{1}{2}$=0.1mol/L,即平衡時甲醇為0.4mol/L-0.3mol/L,故v(CH3OH)=$\frac{0.3mol/L}{10min}$=0.03mol/(L•min),
故答案為:0.03;
(3)生產過程中,合成氣要進行循環,提高原料CO、H2的利用率,
故答案為:提高原料CO、H2的利用率(或提高產量、產率亦可);
(4)“鎂-次氯酸鹽”燃料電池中失電子的為負極,則Mg為負極;正極上ClO-得電子生成氯離子,則正極的電極反應式為:ClO-+2e-+H2O═Cl-+2OH-;
故答案為:負;ClO-+2e-+H2O═Cl-+2OH-;
(5)①N電極上HOOC-COOH得電子生成HOOC-CHO,則電極反應式為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,
故答案為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②N極電極反應式為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,M極電極反應式為:OHC-CHO-2e-+H2O═HOOC-CHO+2H+,2mol H+通過質子交換膜,則電池中轉移2mol電子,可知每一極生成1mol乙醛酸,由于兩極均有乙醛酸生成所以生成的乙醛酸為2mol.
故答案為:2.
點評 本題考查化學平衡計算、原電池原理和電解池原理,是對學生綜合能力的考查,(5)中乙醛酸的計算為易錯點,學生容易忽略兩極都生成乙醛酸,題目難度中等.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:填空題
 濃硫酸有強氧化性,鐵在冷的濃硫酸中能發生鈍化.某興趣小組的同學發現將一定量的鐵與濃硫酸加熱時,觀察到鐵完全溶解,并產生大量氣體.請你協助他們探究所得氣體的成分.
濃硫酸有強氧化性,鐵在冷的濃硫酸中能發生鈍化.某興趣小組的同學發現將一定量的鐵與濃硫酸加熱時,觀察到鐵完全溶解,并產生大量氣體.請你協助他們探究所得氣體的成分.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,下列說法正確的是( )
,下列說法正確的是( )| A. | 該元素位于第3周期第ⅡA族 | B. | 該元素位于第2周期第Ⅷ族 | ||
| C. | 該元素位于第2周期第ⅡA族 | D. | 該元素位于第4周期第ⅡB族 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com