

分析 I.(1)二氧化硫有毒,會導致酸雨,直接排放會污染空氣,可以用于制備硫酸,二氧化硫屬于酸性氧化物,能被堿性溶液吸收;
(2)檢驗SO2用品紅溶液,品紅溶液褪色說明含有SO2;檢驗CO2用澄清石灰水,澄清石灰水變渾濁,說明含有CO2,由于SO2與石灰水反應也生成白色沉淀,會影響CO2的檢驗,故先檢驗SO2,后檢驗CO2,檢驗CO2之前用試劑SO2除去,但選擇試劑不能吸收CO2,不能引入CO2,再經過品紅溶液判斷二氧化硫是否除盡;
Ⅱ.(1)過濾用到的玻璃儀器有:漏斗、燒杯、玻璃棒;
(2)加入氧化劑,將溶液中Fe2+氧化成Fe3+;
(3)FeO與硫酸反應生成硫酸亞鐵,再滴入酸性高錳酸鉀溶液,溶液紫色褪去,可以檢驗FeO存在.
解答 解:I.(1)二氧化硫有毒,會導致酸雨,直接排放會污染空氣,可以用于制備硫酸,二氧化硫屬于酸性氧化物,能被堿性物質吸收,所以可以用石灰水吸收,故選:bc;
(2)檢驗SO2用品紅溶液,品紅溶液褪色說明含有SO2;檢驗CO2用澄清石灰水,澄清石灰水變渾濁,說明含有CO2,由于SO2與石灰水反應也生成白色沉淀,會影響CO2的檢驗,故先檢驗SO2,后檢驗CO2,檢驗CO2之前用試劑SO2除去,但選擇試劑不能吸收CO2,不能引入CO2,再經過品紅溶液判斷二氧化硫是否除盡.
①裝置B的作用是除去SO2,防止影響CO2檢驗,選擇試劑吸收二氧化硫,不能吸收CO2,不能引入CO2,
A.氫氧化鈉溶液與二氧化碳、二氧化硫都反應,故A錯誤;
B.酸性高錳酸鉀溶液氧化二氧化硫為硫酸,不吸收二氧化碳,故B正確;
C.鹽酸不能和二氧化硫、二氧化碳反應,不能吸收二氧化硫,故C錯誤;
D.澄清石灰水和二氧化碳、二氧化硫都能反應,故D錯誤;
故答案為:B;
②裝置C是檢驗二氧化硫是否被B吸收徹底的,
故答案為:檢驗二氧化硫是否被除盡;
③D中澄清石灰水的作用是:檢驗是否含CO2,
故答案為:檢驗是否含CO2;
Ⅱ.(1)過濾用到的玻璃儀器有:漏斗、燒杯、玻璃棒,
故答案為:漏斗、燒杯、玻璃棒;
(2)加入氧化劑,目的是將溶液中Fe2+氧化成Fe3+,
故答案為:將溶液中Fe2+氧化成Fe3+;
(3)FeO與硫酸反應生成硫酸亞鐵,亞鐵離子具有還原性,再滴入酸性高錳酸鉀溶液,溶液紫色褪去,可以檢驗FeO存在,故選:AC.
點評 本題考查物質的制備與檢驗、對實驗裝置的理解、對操作與試劑的分析評價、尾氣處理等,有利于培養學生的分析理解能力及化學實驗能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水,溶液變渾濁,一定有CO32- | |
| B. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- | |
| C. | 加入氫氧化鈉溶液,加熱,產生使濕潤的紅色石蕊試紙變藍的氣體,一定有NH4+ | |
| D. | 加入氨水直至氨水過量,先產生白色沉淀,后沉淀消失,一定有Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的部分數據如圖.下列說法正確的是( )
溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的部分數據如圖.下列說法正確的是( )| A. | 反應在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他條件不變,升高溫度,平衡時c(PCl3)=0.11mol•L-1,則反應的△H<0 | |
| C. | 相同溫度下,起始時向容器中充入2.0 mol PCl3和2.0mol Cl2,達到平衡時,PCl3 的轉化率小于80% | |
| D. | 相同溫度下,起始時向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反應達到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
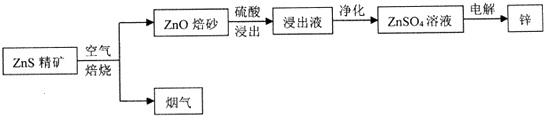
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


| TiCl4 | Mg | MgCl2 | Ti | |
| 熔點/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
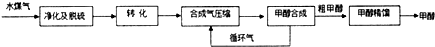
| 物質 | H2 | CO | CH3OH |
| 濃度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com