
| A. | SiO2 | B. | Ar | C. | NaOH | D. | CO |
分析 一般金屬元素與非金屬元素形成離子鍵,非金屬元素之間形成共價鍵,離子晶體中含有離子鍵,以共價鍵結合的物質可能為原子晶體,也可能為分子晶體,在分子晶體中還存在分子間作用力,以此來解答.
解答 解:A.SiO2中只有共價鍵,為原子晶體,故A不選;
B.Ar是稀有氣體,是由原子構成的単原子分子,分子中無化學鍵,分子間存在分子間作用力,故B錯誤;
C.NaOH為離子化合物,含有離子鍵和共價鍵,故C選;
D.CO為共價化合物,C與O間形成共價鍵,分子間存在分子間作用力,所以含有兩種作用力,故D選.
故選CD.
點評 本題考查化學鍵和晶體,注意化學鍵的形成規律及分子晶體中存在分子間作用力即可解答,注意分子中存在分子間作用力是學生解答的難點,難度不大.


 高效智能課時作業系列答案
高效智能課時作業系列答案 捷徑訓練檢測卷系列答案
捷徑訓練檢測卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ3 | D. | X3YZ4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水,溶液變渾濁,一定有CO32- | |
| B. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- | |
| C. | 加入氫氧化鈉溶液,加熱,產生使濕潤的紅色石蕊試紙變藍的氣體,一定有NH4+ | |
| D. | 加入氨水直至氨水過量,先產生白色沉淀,后沉淀消失,一定有Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(NH4+)=2c(SO42-)>c(H+)=c(OH-) | B. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | ||
| C. | c(SO42-)>c(NH4+)>c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3-、CNO- | ||
| C. | CO32-、NO3-、BeCl2 | D. | SiF4、SiO44-、SO42-、PO43- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發生化學反應時失去電子越多的金屬原子,還原能力越強 | |
| B. | 金屬陽離子被還原后,一定得到該元素的單質 | |
| C. | 核外電子總數相同的原子,一定是同種元素的原子 | |
| D. | 化合反應和置換反應均屬于氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的部分數據如圖.下列說法正確的是( )
溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡.反應過程中測定的部分數據如圖.下列說法正確的是( )| A. | 反應在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他條件不變,升高溫度,平衡時c(PCl3)=0.11mol•L-1,則反應的△H<0 | |
| C. | 相同溫度下,起始時向容器中充入2.0 mol PCl3和2.0mol Cl2,達到平衡時,PCl3 的轉化率小于80% | |
| D. | 相同溫度下,起始時向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反應達到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
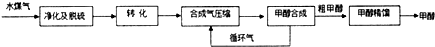
| 物質 | H2 | CO | CH3OH |
| 濃度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com