
| A. | 0.1 mol•L-1CaCl2溶液中含氯離子數為0.2 NA | |
| B. | 0.1 mol鐵粉與過量的氯氣完全反應,轉移電子數為0.2NA | |
| C. | 標準狀況下,2.24 L H2O所含的原子總數為0.3 NA | |
| D. | 常溫常壓下,17g NH3含有的電子個數為10NA |
分析 A、溶液體積不明確;
B、鐵與氯氣反應后變為+3價;
C、標況下水為液態;
D、求出氨氣的物質的量,然后根據1mol氨氣中含10mol電子來分析.
解答 解:A、溶液體積不明確,故溶液中的氯離子的個數無法計算,故A錯誤;
B、鐵與氯氣反應后變為+3價,故0.1mol鐵粉與氯氣反應轉移0.3mol電子即0.3NA個,故B錯誤;
C、標況下水為液態,故不能根據氣體摩爾體積來計算其物質的量,故C錯誤;
D、17g氨氣的物質的量為1mol,而1mol氨氣中含10mol電子,即10NA個電子,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 5:3 | B. | 2:3 | C. | 1:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
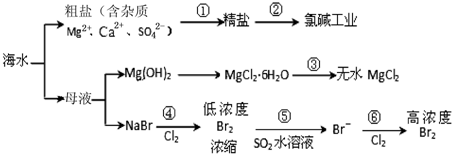
| A. | 除去粗鹽中雜質(Mg2+、Ca2+、SO42-),加入的藥品順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 在過程③中將MgCl2•6H2O灼燒即可制得無水MgCl2 | |
| C. | 在過程④、⑥反應中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 從第④步到第⑥步的目的是為了濃縮富集溴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種氣體所含分子數之比為1:1 | |
| B. | 兩種氣體的摩爾質量之比為1:1 | |
| C. | 兩種氣體所含原子數之比為1:1 | |
| D. | 兩種氣體所含的氧原子的摩爾質量之比為2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等體積、等物質的量濃度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常溫下,將25mL0.2mol/L的鹽酸與100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 將0.1mol/L的Na2S溶液與0.1mol/L的NaHS溶液等體積混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com