
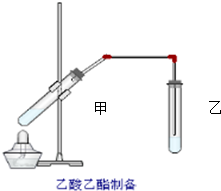
 如圖在試管甲中先加入2mL 95%的乙醇,并在搖動下緩緩加入2mL濃硫酸,充分搖勻,冷卻后再加入2克無水乙酸鈉,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管乙中加入5ml 飽和的碳酸鈉溶液,按圖連接好裝置,用酒精燈對試管甲小火加熱3~5min后,改用大火加熱,當觀察到左試管中有明顯現象時停止實驗.試回答:
如圖在試管甲中先加入2mL 95%的乙醇,并在搖動下緩緩加入2mL濃硫酸,充分搖勻,冷卻后再加入2克無水乙酸鈉,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管乙中加入5ml 飽和的碳酸鈉溶液,按圖連接好裝置,用酒精燈對試管甲小火加熱3~5min后,改用大火加熱,當觀察到左試管中有明顯現象時停止實驗.試回答:分析 (1)試管乙飽和碳酸鈉溶液中,生成的乙酸乙酯在水溶液上層,試管中觀察到的現象是:溶液分層,在飽和碳酸鈉上層產生有特殊香味的無色液體;
(2)依據實驗基本操作分析,液體混合加熱時液體容積不能超過其容積的三分之一,開始時用小火加熱的原因是加快反應速率,避免反應物的揮發;
(3)濃硫酸的作用是利用酸性和醋酸鈉制乙酸,濃硫酸做酯化反應的催化劑和吸水劑;
(4)加熱反應過程中乙醇、乙酸乙揮發出,長導管起到冷凝作用,不宜伸入試管乙的溶液中是防止加熱不充分發生倒吸;
(5)實驗室里用飽和碳酸鈉溶液冷卻乙酸乙酯的原因:一是利用碳酸鈉溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸鈉能跟乙酸反應吸收乙酸,便于聞到乙酸乙酯的香味,而乙酸乙酯難溶于飽和碳酸鈉溶液,這樣就可以獲得較為純凈的乙酸乙酯液體;
(6)裝置中發生的反應是利用醋酸鈉和濃硫酸反應生成醋酸和乙醇在濃硫酸催化作用下發生酯化反應,生成乙酸乙酯和水.
解答 解:(1)試管乙飽和碳酸鈉溶液中,生成的乙酸乙酯在水溶液上層,試管中觀察到的現象是:液體分層,在飽和碳酸鈉上層產生有特殊香味的無色液體,
故答案為:液體分層,產生氣泡;
(2)液體混合加熱時液體容積不能超過其容積的三分之一,開始時用小火加熱的原因是加快反應速率,避免為反應的反應物的揮發;
故答案為:$\frac{1}{3}$;加快反應速率,同時又防止了反應物未來得及反應而揮發損失;
(3)用酸性和醋酸鈉制乙酸,濃硫酸有吸水性,促進該反應向正反應方向移動,濃硫酸能加快反應速率,所以濃硫酸作酸、催化劑和吸水劑,
故答案為:催化劑、吸水劑;
(4)已知乙酸乙酯的沸點為77℃;乙醇的沸點為78.5℃;乙酸的沸點為117.9℃,加熱反應過程中乙醇、乙酸乙揮發出,長導管起到冷凝作用,不宜伸入試管乙的溶液中是防止加熱不充分發生倒吸;
故答案為:導氣、冷凝;防止加熱不充分而倒吸;
(5)碳酸鈉溶液中的水溶解乙醇,能跟乙酸反應吸收乙酸,便于聞到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯難溶于飽和碳酸鈉溶液,便于分層,
故答案為:除去乙酸乙酯中的乙醇和乙酸,降低乙酸乙酯的溶解度,便于分層析;
(6)裝置中發生的反應是利用醋酸鈉和濃硫酸反應生成醋酸和乙醇在濃硫酸催化作用下發生酯化反應,生成乙酸乙酯和水,反應的化學方程式為2CH3COONa+H2SO4+2CH3CH2OH$→_{△}^{濃硫酸}$2CH3COOC2H5+2H2O+Na2SO4,
故答案為:2CH3COONa+H2SO4+2CH3CH2OH$→_{△}^{濃硫酸}$2CH3COOC2H5+2H2O+Na2SO4.
點評 本題考查乙酸乙酯的制備,題目難度中等,本題注意把握乙酸乙酯的制備原理和實驗方法,學習中注重實驗評價能力的培養.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
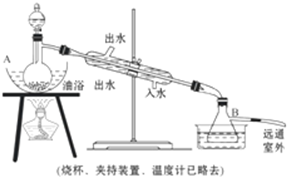
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
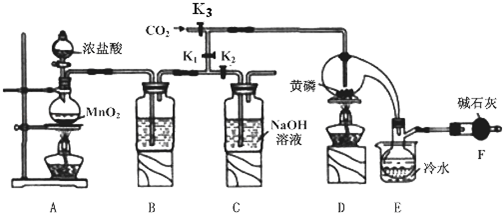
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
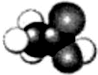 乙酸是食醋的主要成分,它的分子結構模型如圖所示.
乙酸是食醋的主要成分,它的分子結構模型如圖所示.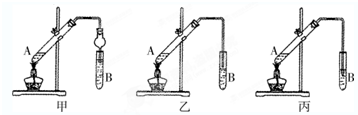
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下,2 mol SO2(g)和1 mol O2(g)的鍵能之和大于2 mol SO3(g)的鍵能 | |
| B. | 如將一定量的SO2(g)和O2(g)置于某密閉容器中充分反應后放熱Q kJ,則此過程中有2 mol SO2(g)被氧化 | |
| C. | 增大壓強或升高溫度,該平衡都向逆反應方向移動 | |
| D. | 將2 mol SO2(g)和1 mol O2(g)置于一密閉容器中充分反應后,放出熱量為Q kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈣在水中的溶解度很小,其水溶液電阻率很大,所以它是弱電解質 | |
| B. | 碳酸鈣在水中的溶解度很小,但溶于水的碳酸鈣完全電離,所以碳酸鈣是強電解質 | |
| C. | 氯氣與氨氣的水溶液導電性好,所以他們是強電解質 | |
| D. | 液態的二氧化硫不導電,但溶于水后溶液導電,所以二氧化硫是強電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向氨水中滴入鹽酸:OH-+H+=H2O | |
| B. | 石灰乳與Na2CO3溶液反應:Ca2++CO32-=CaCO3↓ | |
| C. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 向沸水中逐滴滴加FeCl3飽和溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3 H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| W | Z |
| A. | Z元素氫化物的水溶液一定是強酸 | |
| B. | 四種元素原子形成的簡單離子,半徑最小的一定是Y | |
| C. | 四種元素最高價氧化物對應的水化物酸性最強的一定是Y | |
| D. | 四種元素對應的簡單氫化物穩定性最強的一定是Y |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com