
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
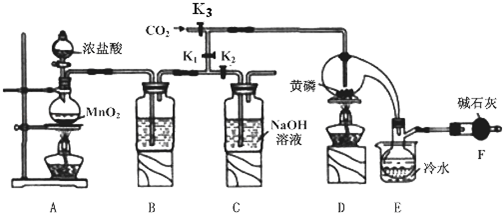
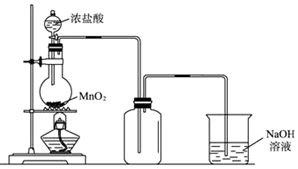
分析 根據裝置圖可知工業生產制取PCl3流程為:A裝置濃鹽酸和二氧化錳二者反應生成氯化錳、氯氣和水,制得氯氣,因PCl3遇水會強烈水解,所以氯氣需干燥,B裝置利用濃硫酸干燥氯氣,利用二氧化碳排盡裝置中的空氣,防止黃磷(白磷)自燃,PCl3沸點為75.5℃,利用E裝置防止PCl3揮發(冷凝),因尾氣中含有有毒氣體氯氣,且空氣中水蒸氣可能進入裝置,所以用F裝置利用堿石灰吸收多余氯氣,防止空氣中的水蒸氣進入燒瓶和PCl3反應;
(1)A裝置中二氧化錳和濃鹽酸反應制取氯氣,據此書寫離子反應方程式;
(2)氯氣為酸性氣體,需用酸性干燥劑干燥,三氯化磷沸點低,可用冷水冷凝收集,堿石灰吸收多余氯氣防止污染空氣,防止空氣中的水蒸氣進入影響產品純度;
(3)白磷能自燃,通入二氧化碳趕凈空氣;
(4)依據物質的沸點數值不同,可以利用蒸餾的方法分離出三氯化磷;
(5)氫氧化鈉與氯氣反應生成氯化鈉、次氯酸鈉和水,據此書寫離子反應方程式;
(6)根據反應的化學方程式H3PO3+H2O+I2=H3PO4+2HI、I2+2Na2S2O3=2NaI+Na2S4O6 可知n(H3PO3)=n(I2)總-n(Na2S2O3)×$\frac{1}{2}$,25mL溶液中H3PO3的物質的量等于PC13的物質的量,再求出PC13的總物質的量和質量,然后求出質量分數.
解答 解:(1)A裝置中,加熱條件下,濃鹽酸和二氧化錳二者反應生成氯化錳、氯氣和水,離子方程式為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)因PCl3遇水會強烈水解,所以氯氣需干燥,氯氣和濃硫酸不反應,所以能用濃硫酸干燥氯氣,PCl3沸點為75.5℃,利用E裝置防止PCl3揮發(冷凝),因尾氣中含有有毒氣體氯氣,且空氣中水蒸氣可能進入裝置,所以用F裝置利用堿石灰吸收多余的Cl2,防止空氣中的水蒸氣進入燒瓶和PCl3反應,
故答案為:濃硫酸;吸收多余的氯氣、防止空氣中的H2O進入燒瓶和PCl3 反應;
(3)通入一段時間的CO2可以排盡裝置中的空氣,防止白磷與空氣中的氧氣發生自燃;
故答案為:排盡裝置中的空氣,防止白磷自燃;
(4)由信息可知,POCl3與PCl3都是液體,沸點相差較大,故可以用蒸餾的方法進行分離,
故答案為:蒸餾;
(5)氫氧化鈉與氯氣反應生成氯化鈉、次氯酸鈉和水,離子方程式為:Cl2+2OH-=Cl-+ClO-+2H2O;
故答案為:Cl2+2OH-=Cl-+ClO-+2H2O;
(6)0.1000mol/L碘溶液10.00mL中含有碘單質的物質的量為:0.1000mol/L×0.0100L=0.00100mol,根據反應I2+2Na2S2O3=2NaI+Na2S4O6可知,與磷酸反應消耗的碘單質的物質的量為:0.00100mol-0.1000mol/L×0.00084L×$\frac{1}{2}$=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mLPC13水解后的溶液中含有的H3PO3的物質的量為:n(H3PO3)=n(I2)=0.00058mol,250mL該溶液中含有H3PO3的物質的量為:0.00058mol×$\frac{250ml}{25ml}$=0.0058mol,所以1.00g產品中含有的PC13的物質的量為0.0058mol,該產品中PCl3的質量分數為:$\frac{137.5g/mol×0.0058mol}{1g}$×100%=79.75%;
故答案為:79.75%.
點評 本題主要考查學生閱讀獲取信息的能力、對實驗原理理解等,是對知識的綜合運用,理解實驗原理是解題的關鍵,需要學生具有扎實的基礎與綜合運用分析解決問題的能力,題目難度較大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:推斷題
| 溫度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
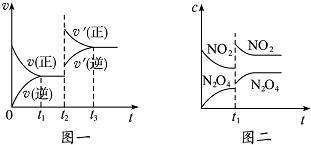
| A. | 圖一t2時改變的條件可能是升高了溫度或增大了壓強 | |
| B. | 圖一t2時改變的條件是增大壓強,則反應的△H增大 | |
| C. | 圖二t1時改變的條件可能是升高了溫度 | |
| D. | 若圖二t1時改變的條件是增大壓強,則混合氣體的平均相對分子質量將增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
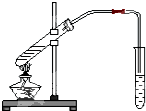 如圖為實驗室制乙酸乙酯的裝置.
如圖為實驗室制乙酸乙酯的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
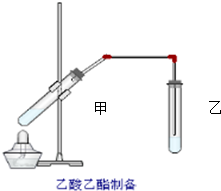 如圖在試管甲中先加入2mL 95%的乙醇,并在搖動下緩緩加入2mL濃硫酸,充分搖勻,冷卻后再加入2克無水乙酸鈉,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管乙中加入5ml 飽和的碳酸鈉溶液,按圖連接好裝置,用酒精燈對試管甲小火加熱3~5min后,改用大火加熱,當觀察到左試管中有明顯現象時停止實驗.試回答:
如圖在試管甲中先加入2mL 95%的乙醇,并在搖動下緩緩加入2mL濃硫酸,充分搖勻,冷卻后再加入2克無水乙酸鈉,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管乙中加入5ml 飽和的碳酸鈉溶液,按圖連接好裝置,用酒精燈對試管甲小火加熱3~5min后,改用大火加熱,當觀察到左試管中有明顯現象時停止實驗.試回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶用蒸餾水洗凈后,可不經干燥直接用于配制溶液 | |
| B. | 配制一定物質的量濃度的稀鹽酸時,用量筒量取9.82 mL濃鹽酸 | |
| C. | 配制1 L 0.1 mol•L-1的NaCl溶液時用托盤天平稱量5.85 g NaCl固體 | |
| D. | 定容時,為防止液滴飛濺,膠頭滴管緊貼容量瓶內壁 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com