
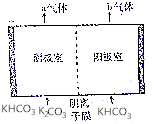
 為實現CO2減排,目前較成熟的方法是用碳酸鉀溶液為吸收劑捕集工業煙氣中的CO2.利用電解法可實現吸收后的溶液(稱為富液)的再生.將富液通人陰極室,將KHCO3溶液加入陽極室進行電解,其原理如圖所示.下列有關描述不正確的是( )
為實現CO2減排,目前較成熟的方法是用碳酸鉀溶液為吸收劑捕集工業煙氣中的CO2.利用電解法可實現吸收后的溶液(稱為富液)的再生.將富液通人陰極室,將KHCO3溶液加入陽極室進行電解,其原理如圖所示.下列有關描述不正確的是( )| A. | 陰極室產生的a氣體是H2 | B. | 陽極室產生的b氣體是CO2 | ||
| C. | 陰離子從陰極室向陽極室遷移 | D. | 再生液(K2CO3)在陰極室產生 |
分析 陰極發生還原反應,2H2O+2e-═H2↑+2OH-,OH-與HCO3-反應得到CO32-,再生碳酸鉀溶液,陽極發生氧化反應,OH-在陽極失電子:2H2O-4e-═O2↑+4H+,產生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在陰極室中的HCO3-、CO32-進入陽極室,發生反應CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以補充,使陽極溶液組成和濃度基本不變.
解答 解:陰極發生還原反應,2H2O+2e-═H2↑+2OH-,OH-與HCO3-反應得到CO32-,陰極室產生的a氣體是H2,再生液(K2CO3)在陰極室產生;
陽極發生氧化反應,OH-在陽極失電子:2H2O-4e-═O2↑+4H+,產生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在陰極室中的HCO3-、CO32-進入陽極室,發生反應CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以補充,使陽極溶液組成和濃度基本不變,陽極室產生的b氣體是O2、CO2,
故選:B.
點評 本題考查電解原理應用,側重考查學生運用知識分析解決問題的能力,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油裂解、海水制鎂、纖維素制火棉都包含化學變化 | |
| B. | 蛋白質、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年諾貝爾化學獎授予三位美國化學家,以表彰他們設計出多尺度復雜化學系統模型,將傳統化學實驗搬到了網絡世界,這一完美結合現實與理論的化學系統模型,為全面了解并預測化學反應進程奠定了基礎 | |
| D. | 一些有機溶劑(如乙醚、乙醇、苯、丙酮等)沸點低極易被引燃,加熱時最好用水浴加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
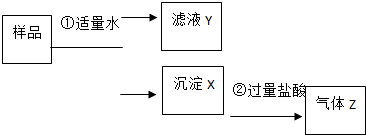 某固體物質是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的幾種均勻混合而成,取樣品進行如下實驗(部分產物略去):
某固體物質是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的幾種均勻混合而成,取樣品進行如下實驗(部分產物略去):查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 溫度/K | 起始物質的量/mol | 平衡物質的量/mol | 平衡常數 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 該反應正反應為吸熱反應 | |
| B. | 607K時,把物質的量均為0.1mol四種反應物加入該反應器中,反應將向正反應方向進行 | |
| C. | 實驗Ⅱ達到平衡時容器中COS的物質的量為0.02mol | |
| D. | 實驗Ⅲ中,無論是開始還是至化學平衡狀態,混合氣體的密度始終不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com