
 影響化學反應速率的因素很多,某學校化學小組用實驗的方法進行探究.他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5mol/L、2mol/L、18.4mol/L),設計實驗方案來探究影響化學反應速率的因素.甲同學的實驗報告如下表:
影響化學反應速率的因素很多,某學校化學小組用實驗的方法進行探究.他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5mol/L、2mol/L、18.4mol/L),設計實驗方案來探究影響化學反應速率的因素.甲同學的實驗報告如下表:| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積2mol/L的硫酸于試管中 ②分別投入大小、形狀相同的Cu、Fe、Mg | 反應速率Mg>Fe,Cu反應最慢 | 金屬性質越活潑,反應 速率越快 |
分析 (1)根據表中數據可知,硫酸的濃度相同,不同金屬的規格相同,說明實驗目的是探究反應物本身對反應速率的影響;影響反應速率的還有溫度,所以應該使反應溫度相同;
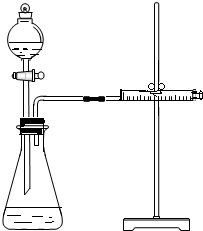
(2)根據圖示裝置及選取的試劑可知,實驗目的是通過測定反應生成氫氣快慢進行判斷濃度對反應速率的影響;
(3)根據v=$\frac{△V}{△t}$確定測乙同學在實驗中應該測定的數據;
(4)金屬和酸反應生成氫氣,注意濃硫酸能夠使Fe鈍化,且與Cu和Mg發生氧化還原反應.
解答 解:(1)根據表中的信息得出該同學的實驗目的是研究反應物本身的性質對反應速率的關系對反應速率的影響,根據表中數據可知,硫酸的濃度相同,不同金屬的規格應相同,
故答案為:分別投入大小、形狀相同的Cu、Fe、Mg;
(2)根據表中的信息得出該同學的實驗目的是研究反應物本身的性質對反應速率的關系對反應速率的影響,溫度對化學反應速率的影響較大,故根據控制變量法,要得出正確的實驗結論,還需控制的實驗條件是保持溫度相同,
故答案為:探究金屬(反應物)本身的性質與反應速率的關系;溫度相同;
(3)乙同學為了更精確地研究濃度對反應速率的影響,根據v=v=$\frac{△V}{△t}$可知,應該測定的實驗數據是測定一定時間產生氣體的體積或測定產生一定體積的氣體所需時間,
故答案為:測定一定時間產生氣體的體積或測定產生一定體積的氣體所需時間;
(4)乙同學為了更精確地研究濃度對反應速率的影響,利用如圖1裝置進行定量實驗,圖1中藥品是金屬和酸,濃硫酸和鐵發生鈍化現象而影響判斷,所以完成該實驗應選用的實驗藥品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸,
故答案為:Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
點評 本題考查探究影響化學反應速率的因素,題目難度中等,注意做對比實驗時只能改變一個條件,其它條件必須相同,明確影響化學反應速率的因素為解答關鍵.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 操 作 | 現 象 |
| 取4g漂粉精固體,加入100mL水 | 部分固體溶解,溶液略有顏色 |
| 過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
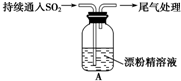 | ⅰ.液面上方出現白霧; ⅱ.稍后,出現渾濁,溶液變為黃綠色; ⅲ.稍后,產生大量白色沉淀,黃綠色褪去 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2的比例模型: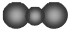 | |
| B. | 氫化銨(NH4H)電子式: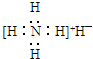 | |
| C. | (CH3)3COH的名稱:2,2-二甲基乙醇 | |
| D. | 乙酸乙酯的水解CH3COOCH2CH3+H218O $?_{△}^{酸}$CH3CO18OH+CH3CH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
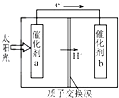 人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.如圖是通過人工光合作用制備HCOOH的原理示意圖,下列說法正確的是( )
人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.如圖是通過人工光合作用制備HCOOH的原理示意圖,下列說法正確的是( )| A. | 該過程可以實現太陽能與電能的直接轉換 | |
| B. | 催化劑a表面發生氧化反應,有O2產生 | |
| C. | 催化劑b附近酸性增強,催化劑a附近酸性減弱 | |
| D. | 催化劑a表面的反應是CO2+2H++2e-═HCOOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 如圖裝置中,a、b都是惰性電極,通電一段時間后,b極附近溶液呈紅色,回答下列問題:
如圖裝置中,a、b都是惰性電極,通電一段時間后,b極附近溶液呈紅色,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 電極反應式 | 出現環境 | |
| A | O2+2H2O+4e-═4OH- | 堿性環境下氫氧燃料電池的負極反應 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性環境下鋼鐵的吸氧腐蝕 |
| C | 2H2O+2e-═H2↑+2OH- | 用Cu作電極電解NaOH溶液的陰極反應 |
| D | H2-2e-═2H+ | 用惰性電極電解H2SO4的陽極反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com