
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入幾滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$變大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等濃度的:NaHCrO4溶液與NaHCO3溶液中,水的電離程度前者大 |
分析 A、H2CrO4═HCrO${\;}_{4}^{-}$+H+,說明鉻酸的第一步電離為完全電離,0.05 mol•L-1H2CrO4溶液電離出氫離子的濃度為0.05mol/L,由于HCrO${\;}_{4}^{-}$?CrO${\;}_{4}^{2-}$+H+ Ka=3.2×10-7mol.L-1,此步為不完全電離,故電離生成的氫離子濃度小于0.05mol/L,據此解答即可;
B、向鉻酸溶液中滴加NaOH,促進第二步電離平衡右移,c(CrO${\;}_{4}^{2-}$)濃度增大,c(HCrO${\;}_{4}^{-}$)濃度減小,據此解答即可;
C、任何溶液中存在電荷守恒,據此解答即可;
D、由于鉻酸的第一步電離完全,故NaHCrO4為強酸強堿鹽,據此解答即可.
解答 解:A、由于鉻酸的第二步電離存在電離平衡,故為不完全電離,即0.05 mol•L-1H2CrO4溶液電離出的氫離子濃度小于0.1mol/L,故pH>1,故A錯誤;
B、向100 mL0.l mol•L-1 H2CrO4溶液中滴入幾滴NaOH溶液,HCrO${\;}_{4}^{-}$?CrO${\;}_{4}^{2-}$+H+平衡右移,c(CrO${\;}_{4}^{2-}$)濃度增大,c(HCrO${\;}_{4}^{-}$)濃度減小,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$變大,故B正確;
C、Na2CrO4溶液中:c(Na+)+c(H+)=2c(CrO42-)+c(HCrO4-)+c(OH-),即CrO42-帶2個單位負電荷,化學計量數應為2,故C錯誤;
D、鉻酸的第一步電離完全,故NaHCrO4為強酸強堿鹽,即NaHCrO4對水的電離無影響,但NaHCO3為弱酸強堿鹽,促進水的電離,故兩者相比,水的電離程度后者大,故D錯誤,故選B.
點評 本題主要考查的是弱酸的電離以及電離平衡的影響因素與平衡的移動問題,注意容易出錯的是D選項,利用所給信息:鉻酸的第一步電離完全判斷,有一定的難度.


 優生樂園系列答案
優生樂園系列答案 新編小學單元自測題系列答案
新編小學單元自測題系列答案科目:高中化學 來源: 題型:填空題
 日常生活中的手電筒干電池通常是鋅錳電池,其構造示意圖如下:
日常生活中的手電筒干電池通常是鋅錳電池,其構造示意圖如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL2% H2O2溶液 | 無 |
| ② | 10mL5% H2O2溶液 | 無 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
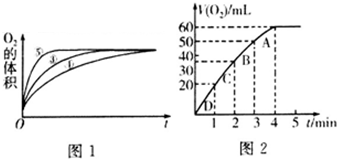
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
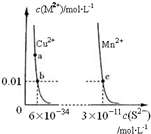
| A. | 該溫度下,Ksp(CuS)小于Ksp(MnS) | |
| B. | 向CuSO4溶液中加入MnS發生如下反應:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固體的溶液中c(Cu2+):c(Mn2+)為2×10-23:1 | |
| D. | a點對應的 Ksp大于b點對應的Ksp |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X | B. | 氣態氫化物的穩定性:X<Z | ||
| C. | 最外層電子數:Y>W | D. | Y、z的氧化物都是兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.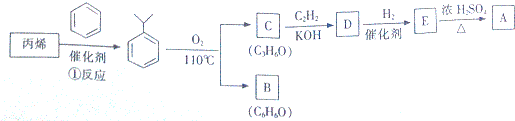
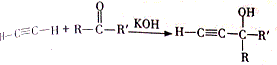
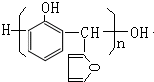
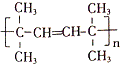 ,該反應的類型是加聚反應;B遇FeCl3溶液顯紫色,B的名稱是苯酚.
,該反應的類型是加聚反應;B遇FeCl3溶液顯紫色,B的名稱是苯酚.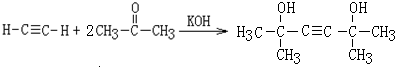 .
.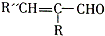 +H2O
+H2O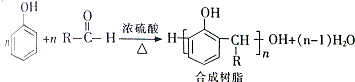
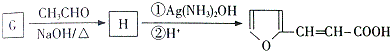
 .
.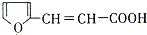 的所有同分異構體的結構簡式
的所有同分異構體的結構簡式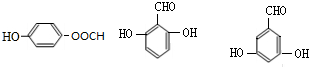 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 ;
; 、和
、和 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .請回答:
.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | Ⅰ | Ⅱ | Ⅲ |
| 實驗 內容 | 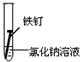 | 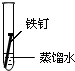 | 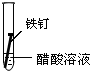 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com