
分析 (1)若鐵與濃硝酸反應生成的完全為二氧化氮,根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,當C為0時生成氣體的量最少,則10g鐵完全反應生成二氧化氮的物質的量為:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以鐵與硝酸反應生成的氣體為NO、NO2的混合物;再根據氣體用50.00mL 12.00mol/L的NaOH溶液(氫氧化鈉遠遠過量)完全吸收后,只生成兩種鹽可知,生成的鹽為碳酸鈉和亞硝酸鈉,說明生成的NO、NO2的物質的量相等,設NO、NO2的物質的量都為x,該碳素鋼中含有C為y,
根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC與濃硝酸反應生成ymol二氧化碳、4ymol二氧化氮,
鐵與濃硝酸反應生成的二氧化氮為:x-4y,根據反應Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,該鋼中含有鐵的物質的量為:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根據該鋼的質量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,再根據氣體的總物質的量可得:②y+2x=0.3,聯立①②計算出x、y,再計算出該鋼樣的含碳量;
(2)根據(1)計算結果及反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O計算出反應中消耗硝酸的總物質的量.
解答 解:(1)若鐵與濃硝酸反應生成的完全為二氧化氮,根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,當C為0時生成氣體的量最少,則10g鐵完全反應生成二氧化氮的物質的量為:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以鐵與硝酸反應生成的氣體為NO、NO2的混合物;再根據氣體用50.00mL 12.00mol/L的NaOH溶液(氫氧化鈉遠遠過量)完全吸收后,只生成兩種鹽可知,生成的鹽為碳酸鈉和亞硝酸鈉,說明生成的NO、NO2的物質的量相等,設NO、NO2的物質的量都為x,該碳素鋼中含有C為y,
根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC與濃硝酸反應生成ymol二氧化碳、4ymol二氧化氮,
鐵與濃硝酸反應生成的二氧化氮為:x-4y,根據反應Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,該鋼中含有鐵的物質的量為:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根據該鋼的質量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,
根據氣體的總物質的量可得:②y+2x=0.3,
聯立①②解得:x=0.144mol、y=0.012mol,
即:該鋼中含有0.012molC,其含碳量為:$\frac{12g/mol×0.012mol}{10.00g}$×100%=1.44%,
答:該鋼樣的含碳量為1.44%;
(2)0.012molC消耗硝酸的物質的量為:0.012mol×4=0.048mol,
生成0.144molNO消耗硝酸的物質的量為:0.144mol×4=0.576mol,
鐵與濃硝酸反應生成二氧化氮的物質的量為:0.144mol-0.012mol×4=0.096mol,反應生成0.096mol二氧化氮消耗硝酸的物質的量為:0.096mol×$\frac{6}{3}$=0.192mol,
所以反應中消耗硝酸的總物質的量為:0.048mol+0.576mol+0.192mol=0.816mol,
答:參加反應的硝酸的物質的量為0.816mol.
點評 本題考查了混合物反應的計算,題目難度較大,根據生成氣體的量及生成兩種鹽判斷反應氣體組成及生成固體的組成為解答關鍵,注意明確一氧化氮、二氧化氮與氫氧化鈉溶液的反應原理,試題側重考查學生的分析、理解能力.


科目:高中化學 來源: 題型:解答題
 如圖表示的是在800℃時,含有A、B、C三種氣體的體系中各物質濃度隨時間變化的情況,請回答:
如圖表示的是在800℃時,含有A、B、C三種氣體的體系中各物質濃度隨時間變化的情況,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
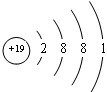
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.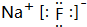 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原原理 | B. | 溶解沉淀原理 | C. | 平衡移動原理 | D. | 物質兩性原理 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10ml0.5mol/LCH3COONa溶液與6mL1mol/L鹽酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH為4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
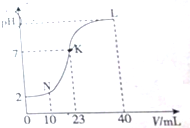
| A. | K點時的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N點時的溶液:2c(M+)=c(A-) | |
| C. | L點時的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水電離的程度:K>L>N |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com