
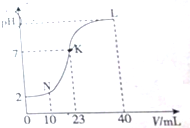
| A. | K點時的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N點時的溶液:2c(M+)=c(A-) | |
| C. | L點時的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水電離的程度:K>L>N |
分析 由圖象可知,0.01 mol•L-1 HA溶液的pH=2,故酸HA為強酸,當加入20mL0.01mol/L的MOH溶液時,兩者恰好完全反應,此時溶液顯酸性,說明MOH為弱堿.
A、K點時,溶液顯中性,溶液中n(OH-)=n(H+),根據溶液的電中性來分析;
B、在N點時,HA酸的物質的量是MOH的二倍,混合時HA過量,混合后所得溶液是等濃度的HA和MA的混合溶液,根據物料守恒來分析;
C、在L點時,MOH的物質的量是HA的二倍,故所得混合溶液中是MA和等物質的量的MOH的混合溶液;
D、酸和堿對水的電離有抑制作用,鹽的水解對水的電離有促進作用.
解答 解:由圖象可知,0.01 mol•L-1 HA溶液的pH=2,故酸HA為強酸,當加入20mL0.01mol/L的MOH溶液時,兩者恰好完全反應,此時溶液顯酸性,說明MOH為弱堿.
A、K點時,溶液顯中性,溶液中n(OH-)=n(H+),根據溶液的電中性可知:n(A-)=n(M+)=2×10-4mol,故A正確;
B、在N點時,HA酸的物質的量是MOH的二倍,混合時HA過量,混合后所得溶液是等濃度的HA和MA的混合溶液,而M+會部分水解為MOH,根據物料守恒有:2[c(M+)+c(MOH)]=c(A-),故B錯誤;
C、在L點時,MOH的物質的量是HA的二倍,故所得混合溶液中是MA和等物質的量的MOH的混合溶液,根據溶液顯堿性可知MOH的電離大于MA的水解:①MOH?M++OH->②M++H2O?MOH+H+,故溶液中的離子濃度為:c(M+)>c(A-)>c(OH-)>c(H+),故C正確;
D、酸和堿對水的電離有抑制作用,鹽的水解對水的電離有促進作用,N點溶液由于HA過量而溶液顯酸性,故N點溶液中水的電離被抑制,L點溶液由于MOH過量而溶液顯堿性,故L點溶液中水的電離也被抑制,而K點溶液顯中性,水的電離無影響,故K點水的電離程度最大;在N點的混合溶液中,c(HA)=c(MA)=$\frac{1}{3}$×10-2mol/L,由于HA是強酸,故溶液中的c(H+)=$\frac{1}{3}$×10-2mol/L,而在L點的溶液中,c(MOH)=c(MA)=$\frac{1}{3}$×10-2mol/L,但由于MOH是弱堿,且MA的存在對MOH的電離有抑制作用,故溶液中的c(OH-)<$\frac{1}{3}$×10-2mol/L,故L點溶液對水的電離的抑制較N點弱,故水電離的程度:K>L>N,故D正確.
故選B.
點評 本題考查了酸堿混合時的定性判斷,注意根據酸溶液的pH和酸的濃度確定酸的強弱,為易錯點,根據物料守恒和電荷守恒來分析解答.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 根據同周期元素的第一電離能變化趨勢,推出P的第一電離能比S大 | |
| B. | 根據主族元素最高正化合價與族序數的關系,推出鹵族元素最高正化合價都是+7 | |
| C. | 晶體中一定存在化學鍵 | |
| D. | 正四面體分子中鍵角只能是109°28′ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | pH=pOH的溶液(pOH是OH-濃度的負對數) | |
| C. | pH=14-pOH的溶液 | |
| D. | 由等體積、等物質的量濃度的一元酸跟氫氧化鈉溶液混合后所形成的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22 | B. | 21 | C. | 20 | D. | 19 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫度升高,壓強增大,平衡可能不移動 | |
| B. | 改變條件,A的轉化率降低,平衡一定向正反應方向移動 | |
| C. | 只增大C的濃度,相當于加壓,平衡向正反應方向移動 | |
| D. | 加入A,再次達平衡,C的體積分數可能降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com