

分析 (1)A、第ⅢA族元素銦的性質與鎵相似,氮化銦的化學式為InN;
B、甲基鎵與氨氣反應時除生成氮化鎵外,根據元素守恒知,還生成CH4;
C、同一主族元素,元素的金屬性隨著原子序數增大而增強;
D、鎵位于元素周期表第四周期第IIIA族;
(2)該金屬氧化物Ga2O3,C元素的穩定氧化物是二氧化碳、H元素的穩定氧化物是水,根據反應物、生成物書寫方程式;
(3)①化學平衡常數K=$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;
②A、①圖象中如果縱坐標為正反應速率,升高溫度或增大壓強,反應速率增大;
B、Ga是固體,沒有濃度可言,不能計算其轉化率;
C、Ga是固體,其質量不影響反應速率;
D、相同壓強下,升高溫度,平衡逆向移動,平均相對分子質量增大;相同溫度下,增大壓強,平衡逆向移動,平均相對分子質量增大;
(4)①陰極上GaO2-得電子發生還原反應生成Ga;
②離子氧化性順序為:Zn2+<Ga3+<Fe2+<Cu2+,則金屬還原性順序為Zn>Ge>Fe>Cu,則陽極上Zn、Ge失電子進入電解質溶液,Fe、Cu以金屬單質進入電解質溶液.
解答 解:(1)A、第ⅢA族元素銦的性質與鎵相似,氮化銦的化學式為InN,故A錯誤;
B、甲基鎵與氨氣反應時除生成氮化鎵外,根據元素守恒知,還生成CH4,故B正確;
C、同一主族元素,元素的金屬性隨著原子序數增大而增強,所以Ga的金屬性大于Al,故C錯誤;
D、鎵位于元素周期表第四周期第IIIA族,故D錯誤;
故選B;
(2)該金屬氧化物Ga2O3,C元素的穩定氧化物是二氧化碳、H元素的穩定氧化物是水,根據反應物、生成物書寫方程式為2Ga(CH3)3+12O2=Ga2O3+6CO2+9H2O,
故答案為:2Ga(CH3)3+12O2=Ga2O3+6CO2+9H2O;
(3)①化學平衡常數K=$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$,故答案為:$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;
②A、①圖象中如果縱坐標為正反應速率,升高溫度或增大壓強,反應速率增大,圖象符合題意,故正確;
B、Ga是固體,沒有濃度可言,不能計算其轉化率,故錯誤;
C、Ga是固體,其質量不影響反應速率,故錯誤;
D、相同壓強下,升高溫度,平衡逆向移動,平均相對分子質量增大;相同溫度下,增大壓強,平衡逆向移動,平均相對分子質量增大,所以溫度高的曲線在上面,故錯誤;
故選A;
(4)陰極上GaO2-得電子發生還原反應生成Ga,電極反應式為GaO2-+3e-+2H2O=Ga+4OH-,故答案為:GaO2-+3e-+2H2O=Ga+4OH-;
②離子氧化性順序為:Zn2+<Ga3+<Fe2+<Cu2+,則金屬還原性順序為Zn>Ge>Fe>Cu,則陽極上Zn、Ge失電子進入電解質溶液,Fe、Cu以金屬單質進入電解質溶液,則陽極泥成分是Fe、Cu,故答案為:Fe、Cu.
點評 本題考查同一主族原子結構和性質,涉及電解原理、化學平衡移動影響因素、化學平衡常數等知識點,綜合性較強,側重考查基本理論,明確電解原理、化學平衡移動原理等知識點即可解答,難點是(3)題圖象分析,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
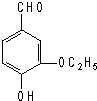
| A. | 1 mol乙基香草醛最多可與1 mol氫氣發生加成反應 | |
| B. | 乙基香草醛可與Br2的CCl4溶液發生加成反應 | |
| C. | 1mol乙基香草醛可與含3 mol NaOH的水溶液完全反應 | |
| D. | 乙基香草醛能被酸性高錳酸鉀、銀氨溶液、新制的氫氧化銅等氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 I、離子液體是一種室溫熔融鹽,為非水體系,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體作電解液時,可在鋼制品上電鍍鋁.
I、離子液體是一種室溫熔融鹽,為非水體系,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體作電解液時,可在鋼制品上電鍍鋁.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙變紅色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 與鋁反應產生大量氫氣的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 糖類物質的分子都可以用Cm(H2O)n來表示 | |
| B. | 凡能溶于水具有甜味的物質都屬于糖類 | |
| C. | 糖類都能發生水解反應 | |
| D. | 糖類是多羥基醛或多羥基酮以及水解能生成它們的化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 8種 | B. | 14種 | C. | 16種 | D. | 18種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com