
 I、離子液體是一種室溫熔融鹽,為非水體系,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體作電解液時,可在鋼制品上電鍍鋁.
I、離子液體是一種室溫熔融鹽,為非水體系,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體作電解液時,可在鋼制品上電鍍鋁.分析 I、(1)依據電鍍原理分析,鋼鐵上鍍鋁是利用鋁做陽極,鋼鐵做陰極,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體做電解液來實現;改用AlCl3水溶液作電解液是溶液中氫離子在陰極放電生成氫氣;
(2)鋁熱反應需要引發劑引發高溫反應,用少量氯酸鉀和鎂條引發,點燃鎂條燃燒放熱使氯酸鉀分解生成氧氣助燃產生反應引發所需要的溫度;鋁熱反應所得的固體混合物,將其溶于足量H2SO4,滴加KSCN溶液無明顯現象,說明無鐵離子,但不能說明固體中不含氧化鐵,因為鋁熱反應生成鐵,溶解于硫酸中鐵可以還原鐵離子為亞鐵離子分析書寫離子方程式;
Ⅱ、(1)分析圖象可知,一氧化碳轉化率隨溫度升高減小,說明平衡逆向進行分析反應能量變化;
(2)結合投料比較少氫氣物質的量,依據化學平衡三段式列式計算平衡濃度,得到A點的平衡常數,AB是相同溫度下的平衡,平衡常數只隨溫度變化分析;
(3)為提高CO轉化率,可以增加氫氣量,提高一氧化碳的轉化率,反應是放熱反應,降低溫度平衡正向進行,依據反應特征和平衡移動原理分析提高一氧化碳轉化率的條件是平衡正向進行.
解答 解:I、(1)依據電鍍原理分析,鋼鐵上鍍鋁是利用鋁做陽極與電源正極相連,鋼鐵做陰極與電源負極相連,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體做電解液來實現,離子液體是一種室溫熔融鹽,為非水體系,電鍍過程中不產生其他離子且有機陽離子不參與電極反應,則陰極反應生成鋁是發生的還原反應,鋁元素化合價降低,分析離子液體成分,結合電荷守恒分析可知是Al2Cl7-得到電子生成,電極反應為:4Al2Cl7-+3e-=Al+7AlCl4-;改用AlCl3水溶液作電解液是溶液中氫離子在陰極放電生成氫氣,2H++2e-=H2↑;
故答案為:負;4Al2Cl7-+3e-=Al+7AlCl4-;H2 ;
(2)鋁熱反應需要引發劑引發高溫反應,用少量氯酸鉀和鎂條引發,點燃鎂條燃燒放熱使氯酸鉀分解生成氧氣助燃產生反應引發所需要的溫度;鋁熱反應所得的固體混合物,將其溶于足量H2SO4,滴加KSCN溶液無明顯現象,說明無鐵離子,但不能說明固體中不含氧化鐵,因為鋁熱反應生成鐵,溶解于硫酸中鐵可以還原鐵離子為亞鐵離子,離子方程式為:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
故答案為:bd;不能;Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
Ⅱ、(1)圖象可知,一氧化碳轉化率隨溫度升高減小,說明平衡逆向,正反應為放熱反應,a<0,
故答案為:<;
(2)若Ⅱ反應的n(CO)起始=10mol、投料比為0.5,n(H2)=20mol,
CO(g)+2H2(g)═CH3OH(g)
起始量(mol/L) 1 2 0
變化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
A點的平衡常數KA =$\frac{0.5}{0.5×1{\;}^{2}}$=1
AB是相同溫度下的平衡,平衡常數只隨溫度變化,所以AB平衡常數相同;
故答案為:1;=;
(3)為提高CO轉化率可采取的措施,可以增加氫氣量,提高一氧化碳的轉化率,反應是放熱反應,降低溫度平衡正向進行,依據反應特征和平衡移動原理分析提高一氧化碳轉化率的條件是平衡正向進行,即減小投料比、較低溫度、增大壓強、分離出CH3OH;
故答案為:減小投料比、較低溫度、增大壓強、分離出CH3OH.
點評 本題考查了電解原理的分析應用鋁熱反應原理分析,化學平衡、平衡常數,反應速率影響因素分析判斷,化學平衡計算,化學平衡的建立過程分析應用,掌握基礎是關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2017屆湖南省長沙市高三上學期第三次月考模擬化學試卷 題型:簡答題
鐵炭混合物(鐵屑和活性炭的混合物)、納米鐵粉均可用于處理水中污染物。
(1)鐵炭混合物在水溶液中可形成許多微電池。將含有Cr2O72-的酸性廢水通過鐵炭混合物,在微電池正極上Cr2O72-轉化為Cr3+,其電極反應式為_____________。
(2)在相同條件下,測量總質量相同、鐵的質量分數不同的鐵炭混合物對水中Cu2+和Pb2+的去除率,結果如圖所示。

①當鐵炭混合物中鐵的質量分數為0時,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②當鐵炭混合物中鐵的質量分數大于50%時,隨著鐵的質量分數的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)納米鐵粉可用于處理地下水中的污染物。
①一定條件下,向FeSO4溶液中滴加堿性NaBH4溶液,溶液中BH4-(B元素的化合價為+3)與Fe2+反應生成納米鐵粉、H2和B(OH)4-,其離子方程式為_________。
②納米鐵粉與水中NO3-反應的離子方程式為4Fe+NO3-+10H+=4Fe2++NH4++3H2O.研究發現,若pH偏低將會導致NO3-的去除率下降,其原因是__________。
③相同條件下,納米鐵粉去除不同水樣中NO3-的速率有較大差異(如下圖),產生該差異的可能原因是____________。

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

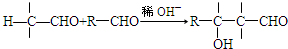

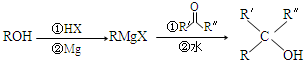
 .X與苯酚生成高聚物反應的化學方程式
.X與苯酚生成高聚物反應的化學方程式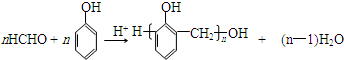 .
.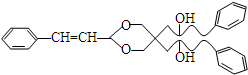 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇能消毒殺菌 | |
| B. | 鋅可用作鋅錳干電池的負極材料 | |
| C. | 糖類、油脂、蛋白質均是有機高分子化合物 | |
| D. | 硅可用于制造太陽能光電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
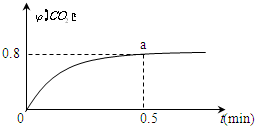 常溫下I2O5(s)可用于檢測CO,反應原理為:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定溫度下,向2L恒容密閉容器中加入足量I2O5(s),并通入1molCO.反應中CO2的體積分數φ(CO2)隨時間的變化如圖所示:
常溫下I2O5(s)可用于檢測CO,反應原理為:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定溫度下,向2L恒容密閉容器中加入足量I2O5(s),并通入1molCO.反應中CO2的體積分數φ(CO2)隨時間的變化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
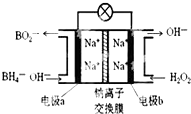 某新型電池NaBH4(B的化合價為+3價)和H2O2作原料,該電池可用作深水勘探等無空氣環境電源,其工作原理如圖所示.下列說法正確的是( )
某新型電池NaBH4(B的化合價為+3價)和H2O2作原料,該電池可用作深水勘探等無空氣環境電源,其工作原理如圖所示.下列說法正確的是( )| A. | 電池工作時Na+從b極區移向a極區 | |
| B. | a極上的電極反應式為:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b極上的電極反應式為:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,轉移3mole- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
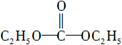 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl常用于保存食物 | |
| B. | 烹魚時加入少量酒、食醋,美味又營養 | |
| C. | 糖類、油脂、蛋白質均為高分子化合物 | |
| D. | 燃煤中加入CaCO3,可減少SO2氣體對大氣的污染 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com