
| A. | 配離子只能存在于晶體中 | |
| B. | 配位體只能是多原子分子 | |
| C. | 配合物的穩定性是指配合物在受熱情況下是否易分解 | |
| D. | 血紅素中的Fe2+與CO形成的配合物比與O2形成的配合物穩定 |
分析 A.配離子也能存在于溶液中;
B.能作為配合物配位體的微粒需含有孤對電子可以是多原子分子,也可為離子;
C.配合物的穩定性指中心離子和配體的結合能力,配合物中配位鍵越強,配合物越穩定;
D.配合物中配位鍵越強,配合物越穩定,中心離子相同,穩定性與配體有關;
解答 解:A.提供空軌道的離子和提供孤電子對的分子或離子能形成配位鍵,配離子可存在于晶體中,也可存在于溶液中,如:SCN-的電子式 ,鐵離子提供空軌道,硫原子提供孤電子對,溶液中絡合物Fe(SCN)3含有配位鍵,故A錯誤;
,鐵離子提供空軌道,硫原子提供孤電子對,溶液中絡合物Fe(SCN)3含有配位鍵,故A錯誤;
B.能作為配合物配位體的微粒需含有孤對電子,可以是多原子、分子如:NH3是共價化合物,氮原子分別與3個氫原子通過一對共用電子對結合,NH3電子式為 ,有孤對電子,可以作為配體,也可為離子如:Cl-為氯原子得到1個電子形成的陰離子,電子式為
,有孤對電子,可以作為配體,也可為離子如:Cl-為氯原子得到1個電子形成的陰離子,電子式為 ,有孤對電子,可以作為配體,故B錯誤;
,有孤對電子,可以作為配體,故B錯誤;
C.配合物的穩定性與配位鍵強弱有關,鍵強弱中心離子受電荷、離子半徑等影響,配體受酸堿性等影響,所以配合物配位鍵越強,配合物越穩定,與受熱情況下是否易分解無關,故C錯誤;
D.血紅素中的Fe2+分別與CO、O2形成的配合物,中心離子Fe2+相同,配體CO形成的配位鍵強,所以Fe2+與CO形成的配合物比與O2形成的配合物穩定,所以人體CO易中毒,故D正確;故選D.
點評 本題考查了配合物的有關知識,掌握配合物的構成以及中心離子和配體間的關系是解答的關鍵,題目難度中等.


 奪冠金卷全能練考系列答案
奪冠金卷全能練考系列答案科目:高中化學 來源: 題型:選擇題
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
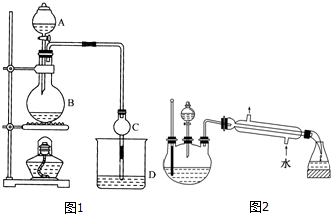
| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
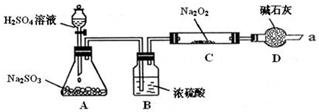

| 實驗步驟 | 現象 |
| ①取少量C中固體產物于試管中,加入適量的蒸餾水溶解. | 固體全部溶解 |
| ②向上試管中加入過量的稀鹽酸,將產生的氣體通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步驟②反應后的試管中,加入適量的BaCl2溶液. | 產生白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18gD2O和18gH2O中含有的質子數均為10NA | |
| B. | 2L0.5mol/L亞硫酸溶液中含有的H+個數為2NA | |
| C. | 過氧化鈉與水反應時,生成0.1mol氧氣轉移的電子數為0.2NA | |
| D. | 密閉容器中2molNO與1molO2充分反應,產物的分子數為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com