
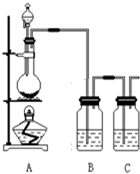
 為了驗證氯元素的非金屬性比碘元素的非金屬性強,某化學實驗小組利用題中所給試劑設計了如下實驗,請回答下列問題:
為了驗證氯元素的非金屬性比碘元素的非金屬性強,某化學實驗小組利用題中所給試劑設計了如下實驗,請回答下列問題:分析 可利用Cl2+2KI=2KCl+I2驗證氯元素的非金屬性比碘元素的非金屬性強,實驗時,A發生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2+2H2O,生成的氯氣經除雜后,與碘化鉀發生氧化還原反應,最后用氫氧化鈉溶液進行尾氣的吸收,以此解答該題.
解答 解:(1)裝置B中盛放的試劑淀粉碘化鉀,發生Cl2+2KI=2KCl+I2,C中盛裝的試劑是吸收多余的氯氣,用氫氧化鈉溶液,故答案為:A;B;
(2)氯氣與碘化鉀發生置換反應,生成碘單質與淀粉變藍,裝置B中實驗現象是淀粉碘化鉀溶液變藍,反應的化學反應方程式Cl2+2KI=2KCl+I2,
故答案為:淀粉碘化鉀溶液變藍;Cl2+2KI=2KCl+I2;
(3)C裝置的作用是吸收多余的氯氣,故答案為:除去多余的氯氣;
(4)能證明氯元素比碘元素非金屬性強的依據:氯原子比碘原子更容易獲得電子形成離子,得電子能力越強非金屬性越強;通過最高價含氧酸的酸性可以比較非金屬性;I-比Cl-還原性強,根據陰離子的還原性越弱非金屬性越強來判斷;氫化物越穩定,非金屬性越強,所以通過高氯酸酸性強于高碘酸,氯的非金屬性強于碘元素的非金屬性,
故答案為:通過高氯酸酸性強于高碘酸,氯的非金屬性強于碘元素的非金屬性.
點評 本題考查物質的性質比較,為高頻考點,注意從實驗裝置著眼,從比較Cl和I的非金屬性強弱著手,從整體的角度把握題目需要解答的問題,要通過本題建立解答本類題的正確思維過程.


 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案 天天向上課時同步訓練系列答案
天天向上課時同步訓練系列答案 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源: 題型:選擇題
| A. | 碳酸氫鈉在水中的電離:NaHCO3═Na++H++CO32- | |
| B. | 鈉與水的反應:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氯氣和水的反應:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 鋁和燒堿溶液的反應:Al+2OH-═AlO-2+H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
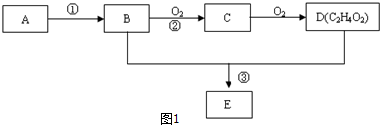
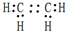 ,D中官能團的名稱為羧基.
,D中官能團的名稱為羧基.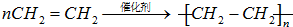 ,反應類型是加聚反應.
,反應類型是加聚反應.
 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
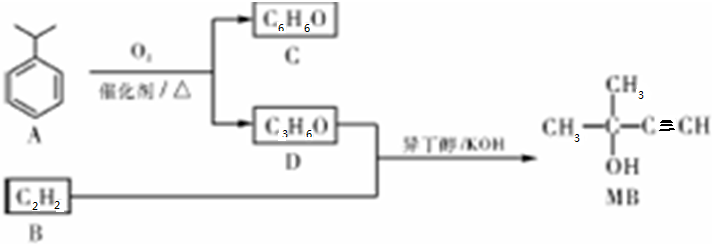
 ,D的官能團名稱為羰基.
,D的官能團名稱為羰基.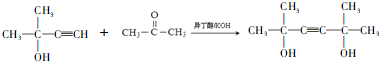 .
. .
.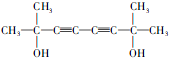 ,醫藥中間體,材料中間體)的合成路線
,醫藥中間體,材料中間體)的合成路線 或
或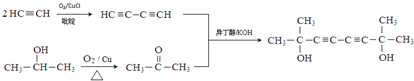 .
.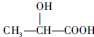 $→_{△}^{濃硫酸}$CH2=CH-COOH$→_{濃硫酸/△}^{CH_{3}OH}$CH-COOH3.
$→_{△}^{濃硫酸}$CH2=CH-COOH$→_{濃硫酸/△}^{CH_{3}OH}$CH-COOH3.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
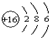 ;該元素最高正化合價與最低負化合價分別是+6和-2.
;該元素最高正化合價與最低負化合價分別是+6和-2.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
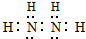 .
. HCO3-+OH-. 0.2mol/L該溶液中離子濃度由大到小的順序為c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L該溶液中離子濃度由大到小的順序為c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Br2和HBrO3均是氧化產物 | |
| B. | BrF3既是氧化劑,又是還原劑 | |
| C. | BrF3的氧化性強于O2 | |
| D. | 反應中,若生成1molBr2,則反應轉移6NA個電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com