
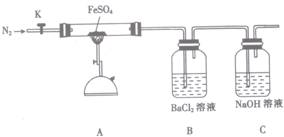
| 操作步驟 | 實驗現象 | 用化學方程式解釋原因 |
| 打開K,通入一段時間的N2,關閉活塞K,加熱A中的玻璃管一段時間 | 洗氣瓶B中①有白色沉淀生成 | ②SO3+H2O+BaCl2=BaSO4↓+2HCl |
| A中固體不再分解后,停止加熱,打開K,緩慢通入氮氣至玻璃管冷卻 | 硬質玻璃管中最終可以看到③有紅棕色固體物質生成 | ④2FeSO4$\frac{\underline{\;高溫\;}}{\;}$Fe2O3+SO2↑+SO3↑ |
分析 (1)硫酸亞鐵(FeSO4)加熱至高溫會分解,生成一種金屬氧化物M和兩種非金屬氧化物,已知M中鐵元素的質量分數為70%,鐵元素質量和氧元素質量計算物質的量之比得到氧化物化學式;
(2)①硫酸亞鐵分解生成氧化鐵中鐵元素化合價升高,則硫元素化合價降低為+4價,生成SO2,硫酸亞鐵(FeSO4)加熱至高溫會分解,生成一種金屬氧化物M和兩種非金屬氧化物,依據氧化還原反應電子守恒可知,生成氣體中含有三氧化硫,三氧化硫溶于水生成硫酸,和氯化鋇反應生成硫酸鋇沉淀;
②分析可知硬質玻璃管中剩余固體為氧化鐵為紅色固體;
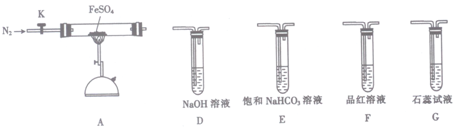
(3)驗證硫酸亞鐵分解產物中含有的另一種非金屬氧化物N為SO2,二氧化硫能使品紅溶液褪色,二氧化硫氣體污染空氣需要用氫氧化鈉溶液吸收.
解答 解:(1)硫酸亞鐵(FeSO4)加熱至高溫會分解,生成一種金屬氧化物M和兩種非金屬氧化物,金屬氧化物為鐵的氧化物,鐵元素70%,氧元素占30%,鐵元素和氧元素物質的量之比=$\frac{70%}{56}$:$\frac{30%}{16}$=2:3,化學式為Fe2O3,
故答案為:Fe2O3;
(2)硫酸亞鐵(FeSO4)加熱至高溫會分解,生成一種金屬氧化物M為Fe2O3和兩種非金屬氧化物,發生了氧化還原反應,則非金屬氧化物應為SO2、SO3生成,打開K,通入一段時間的N2,關閉活塞K,加熱A中的玻璃管一段時間洗氣瓶B中會生成白色沉淀,三氧化硫通入氯化鋇溶液生成硫酸鋇沉淀,反應的化學方程式為:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固體不再分解后,停止加熱,打開K,緩慢通入氮氣至玻璃管冷卻,硬質玻璃管中最終可以看到有紅色固體生成,反應的化學方程式為:2FeSO4$\frac{\underline{\;高溫\;}}{\;}$Fe2O3+SO2↑+SO3↑,
故答案為:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有紅棕色固體物質生成;④2FeSO4$\frac{\underline{\;高溫\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(3)①驗證硫酸亞鐵分解產物中含有的另一種非金屬氧化物N為SO2,二氧化硫遇到品紅溶液會褪色,所以檢驗二氧化硫氣體可以用品紅溶液檢驗二氧化硫的存在,二氧化硫是污染性氣體,需要最后用氫氧化鈉溶液吸收,選擇裝置為FD,
故答案為:F;D;
②能證明生成了非金屬氧化物N的現象是:F中品紅溶液褪色,
故答案為:F中品紅溶液褪色.
點評 本題考查了物質性質實驗方案的設計與評價、物質檢驗的試劑選擇和反應現象,注意實驗過程中發生的氧化還原反應錯誤判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | [Na+]>[A-]>[H+]>[OH-] | B. | [Na+]>[OH-]>[A-]>[H+] | C. | [Na+]+[OH-]=[A-]+[H+] | D. | [Na+]+[H+]=[A-]+[OH-] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④ | B. | ③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 56g鐵粉在1mol氯氣中充分燃燒,失去的電子數為3NA | |
| B. | 1mol 固體Na2O2含有的陰陽離子總數為3NA | |
| C. | 等體積、濃度均為1mol/L的磷酸和鹽酸,電離出的氫離子數之比為3:1 | |
| D. | 1L 1 mol•L-1的NaClO 溶液中含有ClO-的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 吸熱反應在一定條件下也能發生 | |
| B. | 放熱的反應在常溫下一定很易發生 | |
| C. | 反應是吸熱還是放熱必須看反應物和生成物具有的總質量的相對大小 | |
| D. | 需加熱方能發生的反應一定是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用滲析法提純膠體 | |
| B. | 膠體、溶液和濁液這三種分散系的根本區別是分散質粒子直徑的大小 | |
| C. | 膠體微粒不能透過濾紙 | |
| D. | 往25 mL沸水中逐滴加入1~2 mL FeCl3飽和溶液,繼續煮沸可制得Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z的最高價氧化物的水化物能形成多種含Y元素的鹽 | |
| B. | W的氧化物對應水化物的酸性一定強于Z | |
| C. | Y的一種氧化物中含有離子鍵和極性共價鍵 | |
| D. | X的氫化物沸點比Z的氫化物沸點低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com