

| A. | 當電路中轉移0.01 mol e-時,交換膜左側溶液中約減少0.02 mol離子 | |
| B. | 放電時,交換膜右側溶液中有大量白色沉淀生成 | |
| C. | 正極反應為Ag-e-=Ag+ | |
| D. | 用KCl溶液代替鹽酸,則電池總反應隨之改變 |
分析 根據電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,
A.放電時,當電路中轉移0.01mol e-時,交換膜左則會有0.01mol氫離子通過陽離子交換膜向正極移動;
B.放電時,交換膜左側的氫離子向右側移動,銀離子在左側生成AgCl沉淀;
C.正極上氯氣得電子發生還原反應;
D.根據電池總反應為2Ag+Cl2═2AgCl可知,用KCl溶液代替鹽酸,電池的總反應不變.
解答 解:根據電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,
A.放電時,當電路中轉移0.01mol e-時,交換膜左則會有0.01mol氫離子通過陽離子交換膜向正極移動,有0.01mol氯離子反應生成AgCl白色沉淀,所以交換膜左側溶液中約減少0.02 mol離子,故A正確;
B.放電時,交換膜左側的氫離子向右側移動,在負極上有銀離子生成,銀離子在左側和氯離子反應生成AgCl沉淀,故B錯誤;
C.正極上氯氣得電子發生還原反應,正極反應式為Cl2+2e-═2Cl-,故C錯誤;
D.根據電池總反應為2Ag+Cl2═2AgCl可知,用KCl溶液代替鹽酸,電池的總反應不變,故D錯誤;
故選A.
點評 本題考查化學電源新型電池,為高頻考點,明確各個電極上發生的反應是解本題關鍵,易錯選項是AB,注意AgCl在左側生成而不是右側生成,左側有一部分氫離子轉移到右側、有一部分氯離子參加反應生成沉淀,為易錯點.


科目:高中化學 來源: 題型:解答題
 三氟化氮(NF3)是一種無色、無味、無毒且不可燃的氣體,在半導體加工、太陽能電池制造和液晶顯示器制造中得到廣泛應用.它可在銅的催化作用下由F2和過量的NH3反應得到,該反應另一種產物為鹽.
三氟化氮(NF3)是一種無色、無味、無毒且不可燃的氣體,在半導體加工、太陽能電池制造和液晶顯示器制造中得到廣泛應用.它可在銅的催化作用下由F2和過量的NH3反應得到,該反應另一種產物為鹽. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤的主要組成為苯以及苯的同系物 | |
| B. | “可燃冰”為水可能變成油提供了有力的證據 | |
| C. | 油脂、淀粉、纖維素、蛋白質都是高分子化合物 | |
| D. | 石油的裂解是使石油分餾產物中的長鏈烴斷裂成乙烯、丙烯等氣態短鏈烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
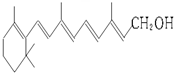
| A. | 維生素A的分子式為C20H30O | |
| B. | 1 mol維生素A最多可與 7 mol H2發生加成反應 | |
| C. | 維生素A分子中含有羥基、碳碳雙鍵和苯環等官能團 | |
| D. | 維生素A是一種易溶于水的醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解精煉銅時,粗銅與電源正極相連 | |
| B. | 在海輪外殼上鑲入鋅塊,是犧牲陽極的陰極保護法 | |
| C. | 用Na2S作沉淀劑,除去廢水中Cu2+和Hg2+ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室溫下不能自發進行,說明該反應的△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、H+、SO42-、OH- | B. | Na+、Mg2+、OH-、NO3- | ||
| C. | Na+、H+、CO32-、Fe2+ | D. | Mg2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )對花香和果香的香韻具有提升作用,故常用于化妝品工業和食品工業.它有很多同分異構體,其中含有酯基和一取代苯結構的同分異構體有五個,請寫出其結構簡式:
)對花香和果香的香韻具有提升作用,故常用于化妝品工業和食品工業.它有很多同分異構體,其中含有酯基和一取代苯結構的同分異構體有五個,請寫出其結構簡式: 、
、 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀釋后,恢復至原溫度,pH增大和KW不變 | |
| C. | 一定溫度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固體,溶液中c(S2-)不變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com