
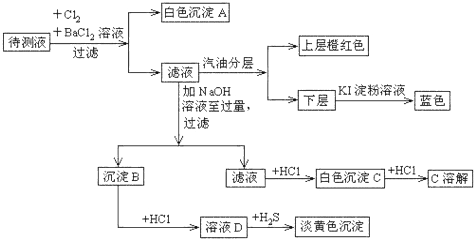
分析 先推斷離子,加氯氣和氯化鋇生成白色沉淀,故A為硫酸鋇沉淀,所以原溶液可能含亞硫酸根離子或硫酸根離子;由分層后的液體顏色說明原溶液含溴離子,加過量氫氧化鈉沉淀B,再加鹽酸溶解后和硫化氫反應出現淡黃色沉淀,說明原溶液含亞鐵離子,由于SO32-與Fe2+、Cu2+、Mg2+會發生反應生成沉淀,所以原溶液不含亞硫酸根離子,故一定含硫酸根離子;濾液加鹽酸先沉淀后溶解,說明原溶液含鋁離子;以上推斷可看出,一定含Fe2+、Al3+、Br-、SO42-,根據以上分析回答即可.
解答 解:先推斷離子,加氯氣和氯化鋇生成白色沉淀,故A為硫酸鋇沉淀,所以原溶液可能含亞硫酸根離子或硫酸根離子;由分層后的液體顏色說明原溶液含溴離子,加過量氫氧化鈉沉淀B,再加鹽酸溶解后和硫化氫反應出現淡黃色沉淀,說明原溶液含亞鐵離子,由于SO32-與Fe2+、Cu2+、Mg2+會發生反應生成沉淀,所以原溶液不含亞硫酸根離子,故一定含硫酸根離子;濾液加鹽酸先沉淀后溶解,說明原溶液含鋁離子;以上推斷可看出,一定含Fe2+、Al3+、Br-、SO42-.
(1)溶液中肯定有的離子是Br-、Al3+、Fe2+、SO42-,故答案為:Br-、Al3+、Fe2+、SO42-;
(2)溶液中存在鋁離子,所以一定不存在碳酸根離子,因為二者之間發生雙水解反應不能大量共存,故答案為:無,與Al3+發生雙水解反應不能大量共存;
(3)由以上分析可知一定含亞鐵離子,鎂離子不能確定是否存在,故沉淀B一定含氫氧化鐵,可能含氫氧化鎂,鐵離子具有氧化性,能將還原性的物質氧化,得到淡黃色的沉淀硫單質,即發生反應:2Fe3++H2S=2Fe2++S↓+2H+,故答案為:Fe(OH)3;2Fe3++H2S=2Fe2++S↓+2H+.
點評 本題考查了離子的推斷,中等難度,要根據特征現象來推斷離子的存在,注意知識的歸納和梳理是解題的關鍵.


科目:高中化學 來源: 題型:填空題
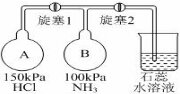
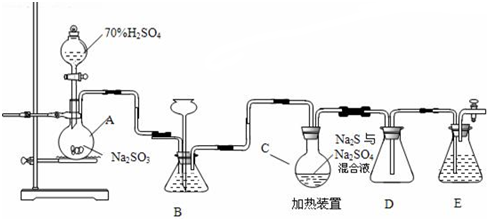
 ClO2與Cl2的氧化性相近,在自來水消毒和果蔬保鮮等方面應用廣泛.某興趣小組通過圖1裝置(夾持裝置略)對其制備、吸收、釋放和應用進行了研究.
ClO2與Cl2的氧化性相近,在自來水消毒和果蔬保鮮等方面應用廣泛.某興趣小組通過圖1裝置(夾持裝置略)對其制備、吸收、釋放和應用進行了研究.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol丙烯酸含有NA個不飽和鍵 | |
| B. | 標準狀況下,11.2L的苯中含有3NA個碳氫鍵 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的陰離子總數大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子數目大于3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
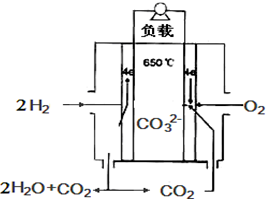 熔融碳酸鹽燃料電池,是由多孔陶瓷陰極、多孔陶瓷電解質隔膜、多孔金屬陽極、金屬極板構成的燃料電池.其電解質是熔融態碳酸鹽.如圖是用熔融碳酸鹽作電解質,氫氣和氧氣形成的燃料電池,下列說法不正確的是( )
熔融碳酸鹽燃料電池,是由多孔陶瓷陰極、多孔陶瓷電解質隔膜、多孔金屬陽極、金屬極板構成的燃料電池.其電解質是熔融態碳酸鹽.如圖是用熔融碳酸鹽作電解質,氫氣和氧氣形成的燃料電池,下列說法不正確的是( )| A. | 該電池放電時,負極的反應式為:H2-2e-+CO32-═H2O+CO2 | |
| B. | 該電池中CO32-的為由左邊移向右邊移動 | |
| C. | 該電池放電時,正極的反應式為:O2+2CO2+4e-═2CO32- | |
| D. | 該電池放電時,當轉移4mol e-時正極消耗1mol O2和2mol CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燈光變暗;二者電離常數相同 | B. | 燈光變暗;電離常數醋酸大于氨水 | ||
| C. | 燈光變亮;電離常數醋酸小于氨水 | D. | 燈光變亮;電離常數醋酸等于氨水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L 1mol/L NaHCO3溶液中自由移動的離子總數為3NA | |
| B. | 常溫常壓下,1.06g Na2CO3含有Na+數目為0.02NA | |
| C. | 1 mol Na2O2與CO2反應電子轉移為2 NA | |
| D. | 40g NaOH溶解在1 L水中,得到溶液的物質的量濃度為1 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
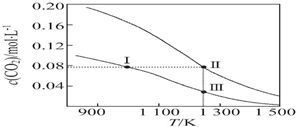
| A. | 反應CO2(g)+C(s)═2CO(g)的△S>0、△H<0 | |
| B. | 體系的總壓強p總:p總(狀態Ⅱ)>2p總(狀態Ⅰ) | |
| C. | 體系中c(CO):c(CO,狀態Ⅱ)>2c(CO,狀態Ⅲ) | |
| D. | 逆反應速率v逆:v逆(狀態Ⅰ)>v逆(狀態Ⅲ) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com