
| A. | 滴加鹽酸時,HCl是還原劑,Cl2是還原產物 | |
| B. | 已知Bi為第ⅤA族元素,上述實驗說明Bi具有較強的非金屬性 | |
| C. | 若有0.1 mol NaBiO3參加了反應,則整個過程轉移電子0.4NA | |
| D. | 此實驗條件下,物質的氧化性:KMnO4>NaBiO3>Cl2 |
分析 根據題意,發生2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O、2Mn2++5BiO3-+14H+=2MnO4-+5Bi3++7H2O,結合反應中元素的化合價變化及氧化性比較規律來解答.
解答 解:根據題意,發生2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O、2Mn2++5BiO3-+14H+=2MnO4-+5Bi3++7H2O,
A.滴加鹽酸時,生成氯氣,Cl元素的化合價升高,則HCl是還原劑,Cl2是氧化產物,故A錯誤;
B.上述反應中Bi得到電子生成Bi3+,+3價較穩定,不能說明Bi單質的氧化性,則不能說明Bi具有較強的非金屬性,故B錯誤;
C.若有0.1 mol NaBiO3參加了反應,則整個過程轉移電子為0.1mol×(5-3)+0.1mol×$\frac{2}{5}$×(7-2)=0.4mol,即0.4NA,故C正確;
D.氧化劑的氧化性大于氧化產物的氧化性,則2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中氧化性為高錳酸鉀的氧化性大于氯氣,2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中NaBiO3的氧化性大于高錳酸鉀,所以氧化性強弱順序是:NaBiO3>KMnO4>Cl2,故D錯誤;
故選C.
點評 本題考查氧化還原反應,為高頻考點,把握發生的氧化還原反應及反應中元素的化合價變化為解答的關鍵,注意從元素化合價角度分析,側重規律性知識及轉移電子的考查,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
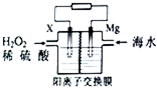 交通運輸部在南海華陽礁舉行華陽燈塔和赤燈塔竣工發光儀式,宣布兩座大型多功能燈塔正式發光并投入使用.燈塔可用鎂海水電池提供能源,其裝置如圖所示.下列有關海水電池的說法正確的是( )
交通運輸部在南海華陽礁舉行華陽燈塔和赤燈塔竣工發光儀式,宣布兩座大型多功能燈塔正式發光并投入使用.燈塔可用鎂海水電池提供能源,其裝置如圖所示.下列有關海水電池的說法正確的是( )| A. | X可為鐵、銅、石墨等電極,發生氧化反應 | |
| B. | 每轉移2 mol電子,2molH+由交換膜左側向右側遷移 | |
| C. | 該電池能將化學能全部轉化成電能 | |
| D. | 正極的電極反應式為比O2+2e-+2H+═2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④⑦⑧⑨⑩ | B. | ②③④⑦⑨⑩ | C. | ①③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 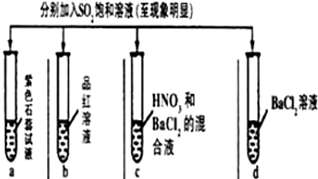 | ||||
| 記錄 | A | 無色 | 無色 | 無色溶液 | 無色溶液 |
| B | 紅色 | 無色 | 白色沉淀 | 白色沉淀 | |
| C | 紅色 | 無色 | 白色沉淀 | 無色溶液 | |
| D | 無色 | 無色 | 無色溶液 | 無色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2用作呼吸面具的供氧劑 | B. | 實驗室制二氧化碳 | ||
| C. | 工業上利用合成氨實現人工固氮 | D. | 工業上電解熔融狀態Al2O3制備Al |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有兩個起始體積相同的密閉容器A和B,A容器有一個可移動的活塞,能使容器內保持恒壓;B容器為固定體積.起始時這兩個容器分別充入等量的體積比為2:1的SO2和O2的混合氣,并使
有兩個起始體積相同的密閉容器A和B,A容器有一個可移動的活塞,能使容器內保持恒壓;B容器為固定體積.起始時這兩個容器分別充入等量的體積比為2:1的SO2和O2的混合氣,并使查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com