
分析 (1)KMnO4溶液具有強氧化性,可氧化橡膠管,且高錳酸鉀溶液為紫色,滴定終點時紫色出現;
(2)由信息及2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,存在5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,以此計算.
解答 解:(1)KMnO4溶液具有強氧化性,可氧化橡膠管,則KMnO4溶液應裝在酸式滴定管中,且高錳酸鉀溶液為紫色,滴定到終點的現象是待測液剛出現紫色且半分鐘內不褪色,
故答案為:酸式滴定管;待測液剛出現紫色且半分鐘內不褪色;
(2)由信息及2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,存在5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,
設10mL血樣中c(Ca2+)=xmol/L,則
5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,
5 2
0.01L×x 0.002L×5.0×10-3mol/L
$\frac{5}{2}=\frac{0.01L×x}{0.002L×5×1{0}^{-3}mol/L}$
50.01L×x×2=0.002L×5.0×10-3mol/L×5,
解得x=2.5×10-3mol/L,
正常人體血液含Ca2+為2.2×10-3~2.7×10-3mol.L-1,
可知此人血液中含鈣量正常,
答:此人血液中含鈣量正常,c(Ca2+)=2.5×10-3mol/L.
點評 本題考查物質含量的測定及計算,為高頻考點,把握滴定原理的應用、關系式的應用為解答的關鍵,側重分析與計算能力的考查,注意分析鈣離子與高錳酸鉀的關系,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 水電解生成氫氣和氧氣,說明水中含有氫分子和氧分子 | |
| B. | 用肥皂水不可以區分硬水和軟水 | |
| C. | 將黃河水經沉降、過濾、吸附,滅菌等凈化操作后,可供人們生活用水 | |
| D. | 水體有一定的自凈功能,部分工業污水可直接排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖,密閉容器內分別充入空氣和H2、O2的混合氣體在可移動的活塞兩邊,在標準狀況下,若將H2、O2的混合氣體點燃引爆,活塞先左彈,恢復原溫度后,活塞右滑停留于容器的中央,則關于原來H2、O2的體積比下列正確的是( )
如圖,密閉容器內分別充入空氣和H2、O2的混合氣體在可移動的活塞兩邊,在標準狀況下,若將H2、O2的混合氣體點燃引爆,活塞先左彈,恢復原溫度后,活塞右滑停留于容器的中央,則關于原來H2、O2的體積比下列正確的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LNO與11.2LO2混合,混合氣體所含分子數為NA | |
| B. | 1molAl3+含有的核外電子數為10NA | |
| C. | 常溫常壓下,1mol氮氣含有的原子總數為2NA | |
| D. | 1L1mol/LFeCl3溶液全部制成膠體,其中含膠粒的數目小于NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃燒硫生成SO3 | B. | SO3與水反應生成H2SO4 | ||
| C. | SO2氧化成SO3需要使用催化劑 | D. | 主要設備是沸騰爐、接觸室、吸收塔 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
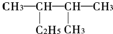 ,下列對該烷烴的系統命名中正確的是( )
,下列對該烷烴的系統命名中正確的是( )| A. | 3-甲基-2-乙基丁烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲戊烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 13.5g | B. | 9g | C. | 27g | D. | 0.33mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴加鹽酸時,HCl是還原劑,Cl2是還原產物 | |
| B. | 已知Bi為第ⅤA族元素,上述實驗說明Bi具有較強的非金屬性 | |
| C. | 若有0.1 mol NaBiO3參加了反應,則整個過程轉移電子0.4NA | |
| D. | 此實驗條件下,物質的氧化性:KMnO4>NaBiO3>Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com