
某小組同學欲探究0.1 mol/L Fe3+溶液與 0.1 mol/L S2-溶液的反應。小組同學先進行理論預測,提出如下三種可能:
a.Fe3+與 S2-發生復分解反應
b.Fe3+與 S2-發生 反應
c.Fe3+與 S2-發生互促水解反應
(1)依據預測a 寫出該反應的離子方程式
(2)將預測b補充完整 ,說明預測依據 。
在進行實驗驗證前,先進行資料收集,得到如下信息:
物質 | 顏色 | 水中溶解性 |
Fe2S3 | 黑色 | 難溶于水 |
FeS | 黑褐色 | 難溶于水 |
進行如下實驗:
實驗步驟 | 操作 | 現象 | 備注 |
1 | 向2 mL 0.1 mol/L氯化鐵溶液中逐滴滴入3滴0.1 mol/L 硫化鈉溶液 | 產生黑色沉淀, 立即變為黃色沉淀,未見其它明顯現象 | 自始至終都未見紅褐色沉淀 |
2 | 繼續滴加3滴0.1 mol/L 硫化鈉溶液 | 同上 | |
3 | 繼續滴加0.1 mol/L 硫化鈉溶液至過量 | 產生黑色沉淀,振蕩后靜置,未發現明顯變化 |
(3)寫出黑色沉淀轉變為黃色沉淀的離子方程式
為進一步探究反應實質,該組同學進行了如下實驗:
實驗步驟 | 操作 | 現象 |
4 | 向2 mL 0.1 mol/L硫化鈉溶液中逐滴滴入3滴0.1 mol/L 氯化鐵溶液 | 產生黑色沉淀,未見其它明顯現象 |
5 | 繼續滴加3滴0.1 mol/L 氯化鐵溶液 | 同上 |
6 | 繼續滴加0.1 mol/L 氯化鐵溶液至過量 | 同上 |
(4)步驟4與步驟1現象不同的原因可能是
(5)有同學認為步驟3中產生的黑色沉淀中可能有FeS。請判斷他的想法是否合理并說明理由
(6)依據以上實驗現象,可得出結論:_________________________。
科目:高中化學 來源:2016-2017學年廣東省肇慶市高二上學期期末化學試卷(解析版) 題型:填空題
(1)對于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________(寫表達式)。
2Ag+(aq)+ S2-(aq),其Ksp=____________(寫表達式)。
(2)下列說法錯誤的是_______:
A.用稀鹽酸洗滌AgCl沉淀比用水洗滌損耗AgCl小;
B.多數物質的溶解度隨溫度的升高而增加,故物質的溶解都是吸熱的;
C.對于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者為溶解平衡,后者為電離平衡;
Al3++3OH-,前者為溶解平衡,后者為電離平衡;
D.除去溶液中的Mg2+,用OH- 沉淀Mg2+ 比 用CO32-效果好,說明Mg(OH)2的溶解度比MgCO3大;
用CO32-效果好,說明Mg(OH)2的溶解度比MgCO3大;
E.沉淀反應中常加過量的沉淀劑,其目的是使沉淀完全。
(3)自然界原生銅的硫化物經氧化、淋濾作用后重生成CuSO4溶液,當這種溶液流向地殼深層遇到閃鋅礦(ZnS)時,便會慢慢轉化為銅藍(CuS)[已知 Ksp(ZnS)=2.93×10-25、Ksp(CuS)=6.3×10-36],發生這種變化的原理是 。
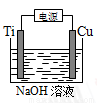
(4)用右圖裝置,堿性條件下可以電解制備納米Cu2O。反應為:2Cu+H2O Cu2O+H2↑,如下圖所示。該電解池的陽極反應式為 。
Cu2O+H2↑,如下圖所示。該電解池的陽極反應式為 。
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省高三1月質檢化學試卷(解析版) 題型:填空題
化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理。請回答下列問題:
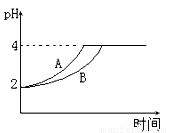
(1)常溫下,取 pH=2的鹽酸和醋酸溶液各100mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如右圖所示。則圖中表示醋酸溶液中pH變化的曲線是 填“A”或“B”)。設鹽酸中加入的Zn質量為m1,醋酸溶液中加入的Zn質量為 m2。 則 m1 m2 ( 選填“<”、“=”、“>”)。[來
(2)在體積為3L的密閉容器中,CO與H2在一定條件下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g)。升高溫度,K值 (填“增大”、“減小”或“不變”)。在500℃,從反應開始到達到平衡,用氫氣濃度變化表示的平均反應速率v(H2)= 。
CH3OH(g)。升高溫度,K值 (填“增大”、“減小”或“不變”)。在500℃,從反應開始到達到平衡,用氫氣濃度變化表示的平均反應速率v(H2)= 。
(3)某溫度下Ksp[ Mg(OH)2] = 2×10 -11,若該溫度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,應調整溶液pH,使之大于 ;該溫度 下,在0.20L的0.002mol/LMgSO4溶液中加入等體積的0.10mol/L的氨水溶液,該溫度下電離常數Kb(NH3·H2O)=2×10-5,試計算 (填“有”或“無”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等體積的0.10mol/L的氨水溶液,該溫度下電離常數Kb(NH3·H2O)=2×10-5,試計算 (填“有”或“無”) Mg(OH)2沉淀生成?
(4)常溫下,某純堿(Na2CO3)溶液中滴入酚酞,溶液呈紅色。在分 析該溶液遇酚酞呈紅色原因時,
析該溶液遇酚酞呈紅色原因時, 甲同學認為是配制溶液所用的純堿樣品中混有NaOH 所致;乙同學認為是溶液中Na2CO3電離出的CO32-水解所致。
甲同學認為是配制溶液所用的純堿樣品中混有NaOH 所致;乙同學認為是溶液中Na2CO3電離出的CO32-水解所致。 請你設計一個
請你設計一個 簡單的實驗方案給甲和乙兩位同學的說法以評判(包括操作、現象和結論) 。
簡單的實驗方案給甲和乙兩位同學的說法以評判(包括操作、現象和結論) 。
查看答案和解析>>
科目:高中化學 來源:2017屆北京市豐臺區高三上學期期末化學試卷(解析版) 題型:選擇題
已知A(g)+B(g)  C(g)+D(g)反應的平衡常數和溫度的關系如下:
C(g)+D(g)反應的平衡常數和溫度的關系如下:
溫度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃時,向一個2 L的密閉容器中充入0.2mol的A和0.8mol的B,反應初始4 s內A的平均反應速率v(A)=0.005mol/(L·s)。下列說法正確的是
A.4 s時c(B)為0.38 mol/L
B.830℃達平衡時,A的轉化率為20%
C.反應達平衡后,升高溫度,平衡正向移動
D.1200℃時反應C(g)+D(g) A(g)+B(g)的平衡常數為0.4
A(g)+B(g)的平衡常數為0.4
查看答案和解析>>
科目:高中化學 來源:2017屆北京市豐臺區高三上學期期末化學試卷(解析版) 題型:選擇題
下列有關性質的比較,不能用元素周期律解釋的是
A. 酸性:H2SO4 >HClO B. 金屬性:Na>Mg
C. 堿性:KOH>NaOH D. 熱穩定性:HC1>HBr
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:選擇題
在1L 恒容密閉容器中充入X(g)和Y(g),發生反應X(g)+Y(g )
) M(g)+N(s),所得實驗數據如下表:
M(g)+N(s),所得實驗數據如下表:
實驗 編號 | 溫度/℃ | 起始時物質的量/mol | 平衡時物質的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列說法不正確的是:
A.實驗①中,5min達平衡,用X表示的平均反應速率v(X)=0.016mol/(L·min)
B.實驗②中,該反應的平衡常數K=12.5
C.實驗②中,達到平衡時,a大于0.16
D.正反應為放熱反應
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:選擇題
NA代表阿伏加德羅常數,下列說法正確的是
A.3.2gO2和O3的混合物中含有的氧原子數目為0.2NA
B.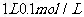 的醋酸溶液中含有氫離子數目為0.1NA
的醋酸溶液中含有氫離子數目為0.1NA
C.標準狀況下,2.24LCCl4含碳原子數目為0.1NA
D.將5.85 g NaCl固體溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省長春市五縣高二上期末化學試卷(解析版) 題型:選擇題
工業廢氣H2S經資源化利用后可回收能量并得到單質硫。反應原理為:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632kJ·mol-1。H2S燃料電池的工作原理如圖所示。下列說法不正確的是( )
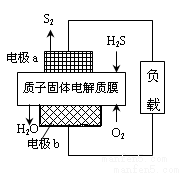
A.電極a為電池的負極
B.電極b上發生的電極反應為O2+4H++4e-=2H2O
C.若電路中通過2mol電子,則電池內部釋放632kJ熱能
D.若有17gH2S參與反應,則會有1molH+經質子膜進入正極區
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江、吉林省兩省六校高二上期中化學試卷(解析版) 題型:填空題
科學家利用太陽能分解 水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以
水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以 甲醇為燃料的燃料電池。請回答下列問題:
甲醇為燃料的燃料電池。請回答下列問題:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃燒熱__________(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的汽化熱為44 kJ/mol,則表示氫氣燃燒熱的熱化學方程式為__________________________。
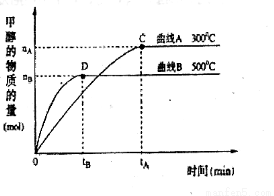
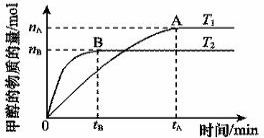
(2)在容積為2 L的密閉容器中,由CO2和H2合成甲醇,在其他條件不變的情況下,考查溫度對反應的影響,實驗結果如下圖所示(注:T1、T2均大于300 ℃)該反應為_________反應(填“放熱”或“吸熱”);在T1溫度時,將1 mol CO2和3 mol H2充入一密閉恒容容器中,充分反應達到平 衡后,若CO2轉化率為a,則容器內的壓強與起始壓強之比為____________________。
衡后,若CO2轉化率為a,則容器內的壓強與起始壓強之比為____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com