
工業廢氣H2S經資源化利用后可回收能量并得到單質硫。反應原理為:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632kJ·mol-1。H2S燃料電池的工作原理如圖所示。下列說法不正確的是( )
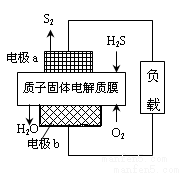
A.電極a為電池的負極
B.電極b上發生的電極反應為O2+4H++4e-=2H2O
C.若電路中通過2mol電子,則電池內部釋放632kJ熱能
D.若有17gH2S參與反應,則會有1molH+經質子膜進入正極區
科目:高中化學 來源:2017屆吉林長春外國語學校高三上期末化學試卷(解析版) 題型:選擇題
某小組設計電解飽和食鹽水的裝置如圖,通電后兩極均有氣泡產生,下列敘述正確的是

A.銅是電解池的陽極
B.石墨電極附近溶液呈紅色
C.銅電極上產生的是無色氣體
D.石墨電極上發生還原反應
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:實驗題
某小組同學欲探究0.1 mol/L Fe3+溶液與 0.1 mol/L S2-溶液的反應。小組同學先進行理論預測,提出如下三種可能:
a.Fe3+與 S2-發生復分解反應
b.Fe3+與 S2-發生 反應
c.Fe3+與 S2-發生互促水解反應
(1)依據預測a 寫出該反應的離子方程式
(2)將預測b補充完整 ,說明預測依據 。
在進行實驗驗證前,先進行資料收集,得到如下信息:
物質 | 顏色 | 水中溶解性 |
Fe2S3 | 黑色 | 難溶于水 |
FeS | 黑褐色 | 難溶于水 |
進行如下實驗:
實驗步驟 | 操作 | 現象 | 備注 |
1 | 向2 mL 0.1 mol/L氯化鐵溶液中逐滴滴入3滴0.1 mol/L 硫化鈉溶液 | 產生黑色沉淀, 立即變為黃色沉淀,未見其它明顯現象 | 自始至終都未見紅褐色沉淀 |
2 | 繼續滴加3滴0.1 mol/L 硫化鈉溶液 | 同上 | |
3 | 繼續滴加0.1 mol/L 硫化鈉溶液至過量 | 產生黑色沉淀,振蕩后靜置,未發現明顯變化 |
(3)寫出黑色沉淀轉變為黃色沉淀的離子方程式
為進一步探究反應實質,該組同學進行了如下實驗:
實驗步驟 | 操作 | 現象 |
4 | 向2 mL 0.1 mol/L硫化鈉溶液中逐滴滴入3滴0.1 mol/L 氯化鐵溶液 | 產生黑色沉淀,未見其它明顯現象 |
5 | 繼續滴加3滴0.1 mol/L 氯化鐵溶液 | 同上 |
6 | 繼續滴加0.1 mol/L 氯化鐵溶液至過量 | 同上 |
(4)步驟4與步驟1現象不同的原因可能是
(5)有同學認為步驟3中產生的黑色沉淀中可能有FeS。請判斷他的想法是否合理并說明理由
(6)依據以上實驗現象,可得出結論:_________________________。
查看答案和解析>>
科目:高中化學 來源:2017屆北京市昌平區高三上學期期末化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子能大量共存的是
A. H+、Na+、SO42﹣、Cu2+ B. Na+、NH4+、H+、CO32﹣
C. K+、Fe2+、H+、NO3﹣ D. Ca2+、Ba2+、SO42﹣、C1﹣
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省長春市五縣高二上期末化學試卷(解析版) 題型:填空題
在一定條件下,在密閉容器中充入1molSO2與2molNO2發生反應:SO2(g)+NO2(g) 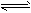 SO3(g)+NO(g) △H=-42kJ·mol-1。請回答下列問題。
SO3(g)+NO(g) △H=-42kJ·mol-1。請回答下列問題。
(1)恒溫恒容下,在反應平衡體系中再充入一定量SO2,則NO2的平衡轉化率__________(填“增大”、“不變”或“減小”,下同)。
(2)恒溫恒壓下,在反應平衡體系中再充入一定量SO2,則NO2的平衡濃度_________。
(3)恒容下,升高溫度,上述反應的平衡常數K為_________。
(4)恒容下,降低溫度,重新達到平衡時 _________。
_________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年吉林省長春市五縣高二上期末化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.原電池的正極材料必須是金屬
B.原電池的負極發生還原反應
C.實驗室欲快速制取氫氣,可利用粗鋅與稀硫酸反應
D.原電池可以把物質內部的能量全部轉化為電能
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江、吉林省兩省六校高一上期中化學試卷(解析版) 題型:填空題
某一反應體系有反應物和生成物共五種物質:O2 、H2CrO4 、Cr(OH)3 、H2O 、H2 O2 已知該反應中H2O2只發生如下過程:H2O2→O2
O2 已知該反應中H2O2只發生如下過程:H2O2→O2
(1)該反應中的還原劑是___________________。
(2)該反應中,發生還原反應的過程是____________ → ________________。
(3)寫出該反應的化學方程式,并標出電子轉移的方向和數目(單線橋表示)___________________。
(4)如反應轉移了0.3mol電子,則產生的氣體在標準狀況下體積為________ L。
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省惠州市高三上第三次調研化學試卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數的值.下列敘述中正確的是( O-16 N-16 )( )
A.1 mol甲基(CH3-)所含的電子數分別為10NA
B.標準狀況下,22.4 L四氯化碳中含有C-Cl鍵的數目為4NA
C.常溫常壓下,1 mol分子式為C2H6O的有機物中,含有C-O鍵的數目為NA
D.46g 由NO2和N2O4組成的混合氣體中,含有的原子總數為3NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com