
| A. | 濃氨水可檢驗氯氣管道漏氣 | |
| B. | 碘是人體必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸鈉溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A、濃氨水揮發出的氨氣和氯氣發生氧化還原反應生成氮氣和氯化銨,反應現象冒白煙;
B、碘是人體必須微量元素,每人每天大約吃食鹽12克,多吃無益;
C、次氯酸根離子具有強的氧化性能夠氧化亞硫酸根離子;
D、氯氣和氫氧化鈉反應生成氯化鈉、次氯酸鈉和水;
解答 解:A、濃氨水揮發出的氨氣和氯氣發生氧化還原反應生成氮氣和氯化銨,3Cl2+8NH3=N2+6NH4Cl,反應過程中現象是冒白煙,濃氨水可檢驗氯氣管道漏氣,故A正確;
B、碘是人體必需微量元素,所以要吃富含KIO3的食鹽,但不能多吃,多吃會導致升高血壓,促進動脈粥樣硬化,故B錯誤;
C、二氧化硫通入次氯酸鈉溶液,反應生成硫酸、氯化鈉,反應的離子方程式為:SO2+ClO-+H2O=SO42-+Cl-+2H+,故C正確
D、氯氣與氫氧化鈉溶液反應的離子方程式為:Cl2+2OH-═Cl-+ClO-+H2O,故D正確;
故選B.
點評 本題考查了離子方程式的正誤判斷,明確電離方程式的書寫注意問題及弱電解質的判斷即可解答,題目較簡單.


科目:高中化學 來源: 題型:解答題
| 容器 | 甲 | 乙 |
| 反應物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡時c(CH3OH) | c1 | c2 |
| 平衡時能量變化 | 放出29.4kJ | 吸收a kJ |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
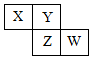 X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )
X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )| A. | Y單質與氫氣反應較Z劇烈 | |
| B. | 最高價氧化物對應水化物酸性W比Z弱 | |
| C. | X單質氧化性強于Y單質 | |
| D. | X與W的原子核外電子數相差9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 進行蒸餾操作時冷凝管進水的方向是上進下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸發方法使NaCl 從溶液中析出時,應將蒸發皿中NaCl 溶液全部加熱蒸干 | |
| D. | 用濃硫酸配制一定物質的量濃度的稀硫酸時,濃硫酸溶于水后,應冷卻至室溫才能轉移到容量瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當溫度一定時,不同的起始條件下可逆反應建立平衡狀態時,平衡常數和轉化率一定是定值 | |
| B. | 依據焓判據:NH4HCO3受熱分解可自發進行 | |
| C. | 大多數化學反應在一定條件下都有一定的限度 | |
| D. | FeCl3與KSCN反應達到平衡時,向其中滴加少量KCl溶液,則溶液顏色變深 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
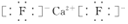 ;Y2與NaOH溶液反應的產物之一是OY2,該反應的離子方程式為2F2+2OH-=OF2↑+2F-+H2O.
;Y2與NaOH溶液反應的產物之一是OY2,該反應的離子方程式為2F2+2OH-=OF2↑+2F-+H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com