
 現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.
現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.| A元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素 |
| B元素原子的核外p電子數比s電子數少1 |
| C原子的第一至第四電離能分別為 I1=738,I2=1451,I3=7733,I4=10540(單位:kJ/mol) |
| D原子核外所有p軌道全滿或半滿 |
| E元素的主族序數與周期數的差為4 |
| F是前四周期中電負性最小的元素 |
| G在周期表的第七列 |
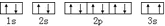 該同學所畫的電子排布圖違背了泡利原理.
該同學所畫的電子排布圖違背了泡利原理.分析 A、B、C、D、E為短周期主族元素,原子序數依次增大,元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素,則A為H;B元素原子的核外p電子數比s電子數少1,電子排布為1s22s22p3,即B為N;由C原子的第一至第四電離能,則C為Mg;D原子核外所有p軌道全滿或半滿,則價電子為3s23p3符號題意,即D為P;E元素的主族序數與周期數的差為4,E為第三周期第ⅥⅠA族元素,即E為Cl;F、G為第四周期元素,它們的原子序數依次增大,F是前四周期中電負性最小的元素,則F為K,G在周期表的第七列,則G為Mn,然后利用原子結構及分子的空間構型來解答.
解答 解:A、B、C、D、E為短周期主族元素,原子序數依次增大,元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素,則A為H;B元素原子的核外p電子數比s電子數少1,電子排布為1s22s22p3,即B為N;由C原子的第一至第四電離能,則C為Mg;D原子核外所有p軌道全滿或半滿,則價電子為3s23p3符號題意,即D為P;E元素的主族序數與周期數的差為4,E為第三周期第ⅥⅠA族元素,即E為Cl;F、G為第四周期元素,它們的原子序數依次增大,F是前四周期中電負性最小的元素,則F為K,G在周期表的第七列,則G為Mn,
(1)水電離的實質是分子結合另一分子的氫離子形成陽離子,另一分子形成陰離子發生電離,故液氨中的電離平衡方程式為:為2NH3?NH4++NH2-,
故答案為:2NH3?NH4++NH2-;
BA5為離子化合物,則為NH4H,其電子式為 ,故答案為:
,故答案為: ;
;
(2)B為N,能量最高的電子為2p電子,其電子云在空間有3個方向,p軌道為紡錘形,
故答案為:3;紡錘形;
(3)由泡利原理可知,電子在同一軌道內的自旋方向應相反,C基態原子的核外電子排布圖中3s上的兩個電子自旋方向相同,則違反了泡利原理,
故答案為:泡利原理;
(4)G為Mn,在第四周期第ⅦB,最后填充的為d電子,在d區,其價電子為3d54s2,
故答案為:第ⅦB;d;3d54s2;
(5)PCl3中,孤電子對數為1,成鍵數為3,則為sp3雜化,空間構型為三角錐形,
故答案為:sp3;三角錐形;
(6)K元素的晶胞如圖所示,該晶胞中K原子個數=1+8×$\frac{1}{8}$=2,晶胞的質量為:$\frac{2M}{{N}_{A}}$g,若設該晶胞的密度為ag/cm3,則晶胞的體積=$\frac{\frac{2M}{{N}_{A}}g}{ag•c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,則晶胞的棱長=$\root{3}{\frac{2M}{a{N}_{A}}}$cm,設F原子的半徑為r cm,晶胞體對角線上的3個F原子相鄰,則:(4r)2=3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2,r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$cm,
故答案為:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$.
點評 本題考查位置、結構、性質的綜合應用,題目難度較大,推斷各元素名稱為解答關鍵,試題側重考查學生的分析、理解能力及靈活應用基礎知識的能力,注意掌握原子結構還與元素周期律、元素周期表的關系.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 按系統命名法,有機物 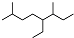 可命名為3,7-二甲基-4-乙基辛烷 可命名為3,7-二甲基-4-乙基辛烷 | |
| B. | 環己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)縮合只能形成1種二肽(不考慮立體異構) | |
| D. | 在一定條件下,1.0 mol的  最多能與含3.0 mol NaOH的溶液完全反應 最多能與含3.0 mol NaOH的溶液完全反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)已知A和B為第三周期元素,其原子的第一至第四電離能如下表所示:
(1)已知A和B為第三周期元素,其原子的第一至第四電離能如下表所示:| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共價鍵 | C-C | C-N | C-S |
| 鍵能/kJ•mol-1 | 347 | 305 | 259 |
| 離子晶體 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
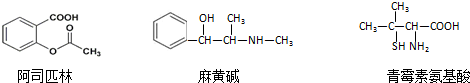
| A. | 三種有機物都能發生酯化反應 | |
| B. | 阿司匹林的苯環上的一氯代物有8種 | |
| C. | 麻黃堿的分子式是C10H15NO,苯環上的一硝基取代物有3種 | |
| D. | 青霉素氨基酸既能與鹽酸反應,又能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
壓強/MPa 轉化率/% 溫度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
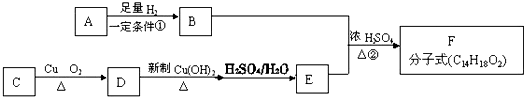
 或
或 或
或 ;
; .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com