
分析 (1)由H2A=H++HA-可知第一步完全電離,為強電解質;
(2)第一步完全電離,第二步部分電離,NaHA溶液中主要存在HA-的電離,可電離出氫離子,則溶液應呈酸性;
(3)0.1mol•L-1H2A溶液,H2A═H++HA-,電離出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,則由HA-?H++A2-可知,電離出0.01mol/LH+,但第一步電離生成的H+抑制了HA-的電離;
(4)NaHA溶液顯酸性,存在HA-?H++A2-,則c(Na+)>c(HA-)>c(H+)>c(OH-),結合水的電離分析.
解答 解:(1)由H2A=H++HA-可知第一步完全電離,為強電解質,故答案為:強電解質;
(2)第一步完全電離,則NaHA溶液中主要存在HA-的電離,發生HA-?A2-+H+,溶液呈酸性,故答案為:酸性;HA-?A2-+H+;
(3)0.1mol•L-1H2A溶液,H2A═H++HA-,電離出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,則由HA-?H++A2-可知,電離出0.01mol/LH+,但第一步電離生成的H+抑制了HA-的電離,所以溶液中氫離子的物質的量濃度小于0.1mol/L+0.01mol/L=0.11mol•L-1,
故答案為:<;
(4)NaHA溶液顯酸性,存在HA-?H++A2-,則c(Na+)>c(HA-)>c(H+)>c(OH-),結合水的電離H2O?H++OH-,則c(H+)>c(A2-),即NaHA溶液中各種離子濃度由大到小的順序為c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案為:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
點評 本題考查學生鹽的水解規律以及離子濃度之間的守恒關系等方面的知識,為高頻考點,側重學生的分析能力的考查,明確習題中的信息是解答本題的關鍵,注意二元酸的兩步電離特點,題目難度中等.


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 5種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
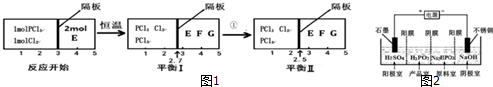
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | A | B | C | D | E |
| 性質或結構信息 | 室溫下單質呈氣態,原子最外層電子數與D相同 | D3B中陽離子與陰離子的電子層結構相同 | A和C可形成兩種常見的化合物甲和乙,乙具有弱酸性 | 單質質軟、銀白色固體、導電性強,在空氣中燃燒生成淡黃色固體 | E是一種氣態氧化物丙,丙相對于空氣的密度為3.0,溶于水可得只含單一溶質的弱酸性溶液,該溶液在放置過程中其酸性會增強 |
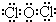 ;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 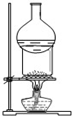 用于I2與NH4Cl混合物的分離 | B. |  可用于制取及觀察Fe(OH)2 | ||
| C. | 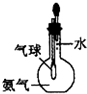 驗證氨氣易溶于水 | D. | 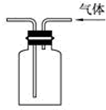 可用于排空氣法收集CO2氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉的化學性質很活潑,在自然界里不能以游離態存在 | |
| B. | 化學的特征就是認識分子 | |
| C. | 在化學反應中,參加反應的各物質的質量比等于其物質的量之比 | |
| D. | 俄國化學家門捷列夫提出原子學說,為近代化學的發展奠定了堅實的基礎 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.
現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.| A元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素 |
| B元素原子的核外p電子數比s電子數少1 |
| C原子的第一至第四電離能分別為 I1=738,I2=1451,I3=7733,I4=10540(單位:kJ/mol) |
| D原子核外所有p軌道全滿或半滿 |
| E元素的主族序數與周期數的差為4 |
| F是前四周期中電負性最小的元素 |
| G在周期表的第七列 |
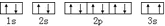 該同學所畫的電子排布圖違背了泡利原理.
該同學所畫的電子排布圖違背了泡利原理.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com