
| A. | 常溫下,78g Na202中含有的陰離子數為2NA | |
| B. | 常溫下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +數為0.1NA | |
| C. | 標準狀況下,22.4 L己烷中含有的共價鍵的數目為19 NA | |
| D. | 30 g SiO2晶體中含有Si-O鍵的數目為2 Na |
分析 A、根據過氧化鈉的物質的量結合一個過氧化鈉化學式中含有的陰離子個數計算總陰離子個數;
B、銨根離子水解導致銨根離子小于0.1mol;
C、標準狀況下己烷不是氣體;
D、1molSiO2晶體存在4molSi-O鍵;
解答 解:A.常溫下,78g Na202的物質的量是n=$\frac{m}{M}$=$\frac{78g}{78g/mol}$=1mol,一個過氧化鈉化學式中含有1個陰離子,78gNa2O2的物質的量是1mol,所以含有的陰離子數是1×6.02×1023,故A錯誤;
B、銨根離子水解導致銨根離子小于0.1mol,所以銨根離子的個數小于0.1NA,故B錯誤;
C、標準狀況下己烷不是氣體,不能使用標況下的氣體摩爾體積計算22.4L己烷的物質的量,故C錯誤;
D、1molSiO2晶體存在4molSi-O鍵,所以30gSiO2晶體物質的量=$\frac{30g}{60g/mol}$=0.5mol,即0.5mol含有2molSi-O鍵,含有Si-O鍵的數目為2 NA ,故B正確;
故選D.
點評 本題主要考查了阿伏加德羅常數的分析判斷,主要是二氧化硅晶體結構,氣體摩爾體積應用條件,鹽類水解分析,難度不大,掌握原子晶體的結構是解題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | NaHCO3溶液與氫氧化鈉溶液反應:HCO3-+2OH-═CO2↑+H2O | |
| C. | 用CH3COOH 溶液CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入過量CO2制Al(OH)3:CO2+AlO2-+2H20═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
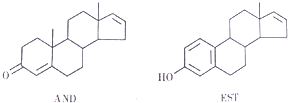
| A. | 這兩種分子均能與NaOH溶液反應 | |
| B. | AND和KST分別與足量氫氣加成后的兩種產物互為同系 | |
| C. | AMD和EST均瓸于芳香族化合物 | |
| D. | EST的M分丼構體中,有的結構中含有蔥環(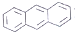 ) ) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
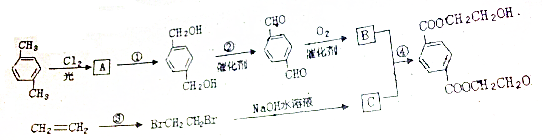
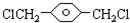 ,
,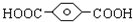 ,HOCH2CH2OH.
,HOCH2CH2OH.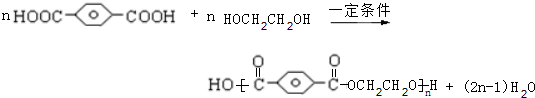 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA個Fe(OH)3膠粒 | |
| B. | 常溫常壓下,0.1molD216O中含中子數、質子數、電子數均為NA | |
| C. | 將0.1molCl2通入1L水中,轉移的電子數為0.1NA | |
| D. | 電解飽和食鹽水,當陰極產生1.12LH2時,轉移的電子數一定為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反應過程中I2置換出Cl2,由此可推斷非金屬性I>Cl | |
| C. | KClO3和KIO3均屬于離子化合物,都只含有離子鍵 | |
| D. | 制備KIO3的反應中氯元素被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe和鹽酸反應:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反應:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和鹽酸反應:CO32-+2H+=CO2↑+H2O | |
| D. | 氫氧化鋇與鹽酸反應:OH-+H+=H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4 | B. | C2H4O | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
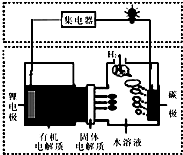
| A. | 碳極發生的反應是:2H2O+O2+4e-═4OH- | |
| B. | 有機電解質通過固體電解質可進入水溶液中 | |
| C. | 理論上,外電路中每轉移1mol電子,負極消耗的質量為7g | |
| D. | 該電池如可以充電,充電時碳極接外加電源的負極,鋰極接外加電池的正極 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com