
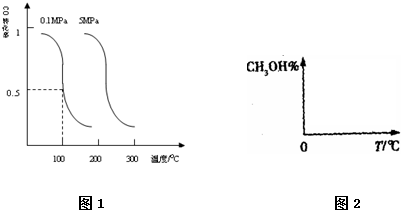
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.5amol |
| bL |
| a |
| 2b |
| a |
| b |
| 0.5amol |
| bL |
| a |
| 2b |
| c(CH3OH) |
| c(CO)c2(H2) |
| a | ||||||
|
| b2 |
| a2 |
| b2 |
| a2 |
 ,
, ;
;


科目:高中化學 來源: 題型:
| A、堿性 Mg(OH)2>Ca(OH)2 |
| B、酸性 H2SO4<H2CO3 |
| C、穩定性 H2S>H2Se |
| D、原子半徑 S>P |
查看答案和解析>>
科目:高中化學 來源: 題型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化學 來源: 題型:
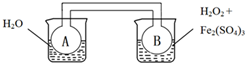
| A、實驗時,A、B中的壓強始終相等 |
| B、若右側燒杯發生吸熱反應,則A中更快達到平衡 |
| C、若右側燒杯發生放熱反應,則A中顏色較深 |
| D、能用該裝置推斷右側燒杯中反應的熱效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:
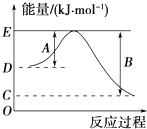 下表列出了斷裂某些化學鍵所需的能量:
下表列出了斷裂某些化學鍵所需的能量:| 化學鍵 | H-H | Cl-Cl | I-I | O═O | O-H | H-Cl | H-I |
| 斷裂1mol化學鍵所吸收的能量(kJ) | 436 | 247 | 151 | x | 463 | 431 | 299 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
| 提供的藥品:Cl2 濃H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| △ |
| ||
| (6-10)×105Pa |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、CO2分子內含有極性鍵,所以CO2分子是極性分子 |
| B、氣態氫化物的穩定性:NH3>PH3>AsH3 |
| C、分子晶體、原子晶體中一定含有共價鍵,離子晶體一定含有離子鍵 |
| D、某非金屬元素從游離態變成化合態時,該元素一定被還原 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com