
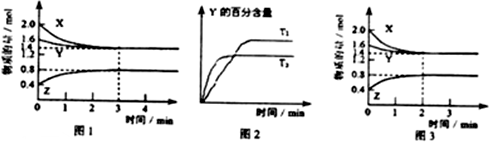
分析 (1)根據圖示1可知:X、Y是反應物,Z是生成物,它們的物質的量的比等于3:2:1,由于最終各種物質都存在,所以該反應是可逆反應.故容器中發生的反應可表示為:3X(g)+Y(g)?2Z(g);
(2)由圖2可知,溫度T2到達平衡需要的時間較短,故T2>T1,溫度越高Y的含量降低,升高溫度平衡向正反應方向移動;
(3)根據v=$\frac{△c}{△t}$計算出反應進行前3min內,用X表示的反應速率v(X);
(4)正反應是吸熱反應,升高溫度,平衡正向移動,該反應的化學平衡K將增大;
(5)①圖3與圖1相比,平衡時各組分的物質的量不變,到達平衡時間縮短,說明改變條件,增大反應速率,平衡不移動,該反應正反應是氣體體積減小的反應,增大壓強平衡向正反應移動,不可能是增大壓強,故改變條件是使用催化劑;
②a.高溫高壓,平衡向正向移動,氣體Y的轉化率增大;
b.加入催化劑,平衡不移動;
c.減少X的濃度,平衡向逆方向移動,氣體Y的轉化率減小;
d.增加氣體Y的濃度,雖然平衡向正向移動,但氣體Y的轉化率減小.
解答 解:(1)由圖1知,X的物質的量減少量為:(2.0-1.4)mol=0.6mol,Y的物質的量減少量為:(1.6-1.4)mol=0.2mol,X、Y為反應物;Z的物質的量增加量為:(0.8-0.4)mol=0.4mol,Z為生成物,同一化學反應同一時間段內,反應物減少的物質的量和生成物增加的物質的量之比等于其計量數之比,所以X、Y、Z的計量數之比=0.6mol:0.2mol:0.4mol=3:1:2,所以反應可表示為:3X(g)+Y(g)?2Z(g),故答案為:3X(g)+Y(g)?2Z(g);
(2)T2先拐溫度高,升高溫度Y的百分含量減小,平衡正向移動,正反應是吸熱反應,故答案為:>;升高溫度,Y的含量降低,說明升高溫度,平衡正向移動,正反應是吸熱反應;
(3)反應進行前3min內,用X表示的反應速率為:v(X)=$\frac{\frac{2.0-1.4}{2}}{3}$=0.1mol/(L•min),故答案為:0.1mol/(L•min);
(4)正反應是吸熱反應,升高溫度,平衡正向移動,該反應的化學平衡K將增大,故答案為:變大;
(5)①由圖3可知:各種物質在2min時就達到了平衡,但是物質的平衡濃度不變,所以平衡未發生移動,因為該反應是反應前后氣體體積不等的可逆反應,則改變的條件是使用催化劑,故答案為:催化劑;
②a.高溫高壓,平衡向正向移動,氣體Y的轉化率增大,故正確;
b.加入催化劑,平衡不移動,故錯誤;
c.減少X的濃度,平衡向逆方向移動,氣體Y的轉化率減小,故錯誤;
d.增加氣體Y的濃度,雖然平衡向正向移動,但氣體Y的轉化率減小,故錯誤;
故選:a.
點評 本題考查了化學平衡的圖象及化學反應速率的計算、化學平衡的影響、平衡移動原理等,題目難度中等,根據圖象正確分析曲線變化特點是解答本題的關鍵,結合平衡移動原理進行解答.


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
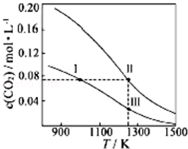
| A. | 體系中c(CO):c(CO,狀態Ⅱ)<2c(CO,狀態Ⅲ) | |
| B. | 反應CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 體系的總壓強P總:P總(狀態Ⅱ)<2P總(狀態Ⅰ) | |
| D. | 逆反應速率V逆:V逆(狀態Ⅰ)>V逆(狀態Ⅲ) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 能源是當今社會發展的三大支柱之一,有專家指出:如果對燃料產物如CO2、H2O、N2等能夠實現利用太陽能讓它們重新組合(如圖),可以節約燃料,緩解能源危機.在此構想的物質循環中太陽能最終轉化( )
能源是當今社會發展的三大支柱之一,有專家指出:如果對燃料產物如CO2、H2O、N2等能夠實現利用太陽能讓它們重新組合(如圖),可以節約燃料,緩解能源危機.在此構想的物質循環中太陽能最終轉化( )| A. | 化學能 | B. | 熱能 | C. | 生物能 | D. | 電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金屬元素 | |
| C. | 可能不是金屬元素也可能是非金屬元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
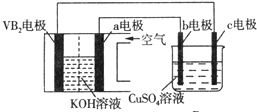
| A. | 電解過程中,c電極表面先有紅色物質析出,后有氣泡產生 | |
| B. | 外電路中電子由c電極流向VB2電極 | |
| C. | VB2電極發生的電極反應為:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B裝置內的液體體積為100 mL,則CuSO4溶液的物質的量濃度為0.05 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com