
工業(yè)上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g)+2N2(g)+6H2(g)  Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某溫度和壓強條件下,分別將1.25mol SiCl4(g)、1.0mol N2(g)、10.5mol H2(g)充入20L密閉容器內,進行上述反應,5min達到平衡狀態(tài),所得Si3N4(s)的質量是35.0g.已知:
化學鍵 | Si-Cl | N≡N | H-H | Si-N | H-Cl |
鍵能(KJ/mol) | a | b | c | d | e |
(1)計算該反應的ΔH=_______________
(2)H2的平均反應速率是
(3)平衡時容器內N2的濃度是
(4)SiCl4(g)的轉化率是 %
(5)下圖為合成Si3N4反應中SiCl4平衡轉化率與溫度、壓強的關系(n(SiCl4)、n(N2)、n(H2)仍按1.25 mol SiCl4(g)、1.0 mol N2(g)、10.5mol H2(g)投入)
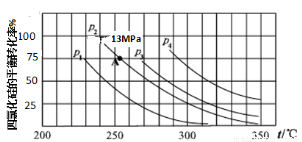
上圖中壓強最大的是_____(P1、P2、P3、P4),列式計算合成Si3N4反應在圖中A點的分壓平衡常數Kp= _______ (用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數,圖中P2=13MPa)
科目:高中化學 來源:2016屆湖北省高三高考前模擬理綜化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.按系統命名法,有機物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名為:2-甲基-3-丙基戊烷
B.已知C-C鍵可以繞鍵軸自由旋轉,結構簡式為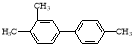 分子中至少有7個碳原子處于同一直線上
分子中至少有7個碳原子處于同一直線上
C.肌醇  與葡萄糖
與葡萄糖 的元素組成相同,化學式均為C6H12O6,滿足Cm(H2O)n,因此,均屬于糖類化合物
的元素組成相同,化學式均為C6H12O6,滿足Cm(H2O)n,因此,均屬于糖類化合物
D. 與足量的NaOH溶液發(fā)生反應時,所得有機產物的化學式為C9H6O6Na4
與足量的NaOH溶液發(fā)生反應時,所得有機產物的化學式為C9H6O6Na4
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省等三校高三第四次模擬化學試卷(解析版) 題型:選擇題
700℃時,向容積為2L的密閉容器中充入一定量的CO和H2O,發(fā)生反應:CO(g)+H2O(g) CO2(g) +H2(g),反應過程中測定的部分數據見下表(表中t1 <t2),下列說法正確的是
CO2(g) +H2(g),反應過程中測定的部分數據見下表(表中t1 <t2),下列說法正確的是

A.反應在t1 min內的平均速率為v(H2)=0.40/t1moI/(L·min)
B.保持其他條件不變,起始時向容器中充入0.60 mol CO和1.20 mol H2,到達平衡時,n(CO2)=0.40 mol
C.保持其他條件不變,向平衡體系中再通入0.20 mol CO,與原平衡相比,達到新平衡時CO轉化率減小,H2O的體積分數也減小
D.溫度升至800℃,上述反應平衡常數為0.64,則正反應為吸熱反應
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月模擬四理綜化學試卷(解析版) 題型:實驗題
乙二醛(OHC-CHO)是一種重要的精細化工產品。
Ⅰ.工業(yè)生產乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反應的化學方程式為 。該法具有原料易得、反應條件溫和等優(yōu)點,但也存在比較明顯的缺點是 。
(2)乙二醇(HOCH2CH2OH)氣相氧化法
① 已知:OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2
乙二醇氣相氧化反應HOCH2CH2OH(g)+O2(g) OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同溫度下,該反應的化學平衡常數K= (用含K1、K2的代數式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同溫度下,該反應的化學平衡常數K= (用含K1、K2的代數式表示)。

② 當原料氣中氧醇比為1.35時,乙二醛和副產物CO2的產率與反應溫度的關系如下圖所示。反應溫度在450~495℃之間和超過495℃時,乙二醛產率降低的主要原因分別是 、
Ⅱ.乙二醛電解氧化制備乙醛酸(OHC—COOH)的生產裝置如下圖所示,通電后,陽極產生的Cl2 與乙二醛溶液反應生成乙醛酸。
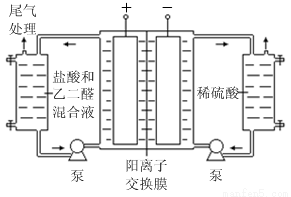
(3)陰極電極式為
(4)陽極液中鹽酸的作用,除了產生氯氣外,還有
(5)保持電流強度為a A,電解t min,制得乙醛酸m g,列式表示該裝置在本次電解中的電流效率η=
(設:法拉第常數為f C·mol-1;η= )
)
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月模擬四理綜化學試卷(解析版) 題型:選擇題
X、Y、Z三種短周期元素,原子半徑的大小關系為:r (Y)>r(X)>r(Z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發(fā)生右圖所示變化,其中B和C均為10電子分子。下列說法不正確的是
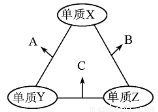
A.X元素位于ⅥA族
B.A難溶于B中
C.A和C不可能發(fā)生氧化還原反應
D.B的沸點高于C的沸點
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月模擬三理綜化學試卷(解析版) 題型:選擇題
下列根據實驗操作和現象所得出的結論或相應的解釋錯誤的是( )
選項 | 實驗操作 | 實驗現象 | 結論或解釋 |
A | 向盛有0.5mol•L-1 Fe(NO3)2溶液的試管中加入0.5mol•L-1 H2SO4溶液 | 在試管口處出現紅棕色氣體 | 溶液中NO3-被Fe2+還原為NO2 |
B | 向PbI2飽和溶液中滴加幾滴0.1mol•L-1 KI溶液 | 出現黃色沉淀 | 說明 PbI2飽和溶液中有Pb2+存在 |
C | 向白色ZnS沉淀上滴加0.1mol•L-1 CuSO4溶液,振搖 | 沉淀變?yōu)楹谏?/p> | ZnS沉淀轉化為CuS沉淀 ZnS(s)+Cu2+(aq) |
D | 相同條件下,用1mol•L-1醋酸溶液和1mol•L-1鹽酸分別做導電性實驗 | 醋酸溶液對應的燈泡較暗 | 醋酸是弱電解質 |
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三下學期猜題理綜化學試卷(解析版) 題型:填空題
純堿是一種非常重要的化學基本工業(yè)產品,工業(yè)上有很多不同的方法生產純堿。
Ⅰ、路布蘭法——其生產原理:用硫酸將食鹽轉化為硫酸鈉,將硫酸鈉與木炭、石灰石一起加熱,得到產品和硫化鈣。
(1)請寫出上述過程的化學方程式:____________。
Ⅱ.索爾維制堿法:以食鹽、氨氣(來自煉焦副產品)和二氧化碳(來自石灰石)為原料,首先得到小蘇打,再加熱分解小蘇打,獲得純堿。
(2)結合下圖中所給物質的溶解度曲線。寫出得到小蘇打的離子方程式:____________。
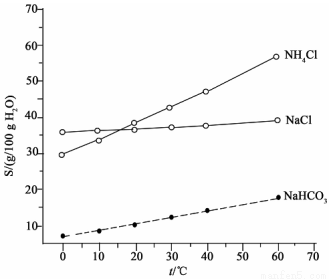
(3)這種生產方法的優(yōu)點是原料便宜、產品純度高、氨和部分二氧化碳可以循環(huán)使用。請寫出實現氨循環(huán)的化學方程式:____________。
Ⅲ.侯德榜制堿法——生產流程可簡要表示如下:
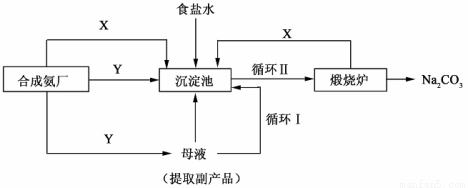
(4)合成氨工廠需要向制堿廠提供兩種原料氣體,其中Y是____________(填化學式),這兩種氣體在使用過程中是否需要考慮通入的先后順序____________(填”是”或“否”),原因是____________。
(5)侯德榜制堿法保留了索爾維法的優(yōu)點,克服了它的缺點,特別是設計了____________(填流程中的編號)使原料中溶質的利用率從70%提高到了96%以上。從母液中可以獲得的副產品的應用:____________(舉一例)。
(6)該合成氨廠用NH3制備NH4NO3。已知:由NH3制NO的產率是94%,NO制HNO3的產率是89%,則制HNO3所用NH3的質量占總耗NH3質量(不考慮其它損耗)的____________%(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三高考打靶測試理綜化學試卷(解析版) 題型:選擇題
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五種陽離子,現用過量的H2SO4、NaOH、NH3·H2O、NaCl四種溶液,按圖所示步驟分開五種離子。下列判斷正確的是

A.沉淀乙是氫氧化鋁和氫氧化銀的混合物
B.溶液3中含有Al3+
C.試劑①是NaCl,試劑④是H2SO4
D.溶液4含有三種陽離子,分別是H+、Na+、K+
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三考前模擬理綜化學試卷(解析版) 題型:選擇題
用均滴有酚酞試液和氯化鈉溶液的濾紙分別制作甲、乙兩個裝置。下列描述正確的是( )
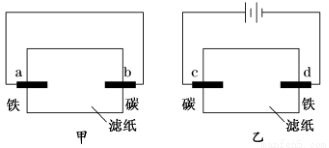
A.濾紙上的陰離子都向碳棒遷移
B.a、d兩極的電極反應式相同
C.b、d兩極附近的溶液都變紅
D.c、d兩極均有少量氣體產生
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com