
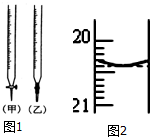
 某校化學興趣小組采用酸堿中和滴定法用0.1000mol/LNaOH溶液滴定待測鹽酸溶液,試回答下面的問題:
某校化學興趣小組采用酸堿中和滴定法用0.1000mol/LNaOH溶液滴定待測鹽酸溶液,試回答下面的問題:分析 (1)由圖可知甲為酸式滴定管,乙為堿式滴定管,氫氧化鈉溶液應用堿式滴定管;
(2)根據滴定終點,錐形瓶中的溶液顏色發生變化,且半分鐘內不褪色;
(3)根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差;
(4)根據滴定管的結構和精確度為0.01mL讀出讀數從而求出NaOH溶液的體積;
(5)若滴定到終點時不慎多滴了一滴NaOH溶液,即0.05mL,此時溶液體積為50mL,反應后溶液中c(OH-)=0.1mol•L-1×$\frac{0.05}{50}$=10-4mol•L-1,根據c(H+)c(OH-)=10-14計算c(H+),進而計算所得溶液的pH.
解答 解:(1)由圖可知甲為酸式滴定管,乙為堿式滴定管,NaOH溶液應用堿式滴定管,即選擇乙注入NaOH溶液,
故答案為:乙;
(2)NaOH溶液滴定待測鹽酸溶液,鹽酸溶液呈酸性,加入酚酞顯無色,滴定終點時,錐形瓶中的溶液從無色變為淺紅色時,且半分鐘內不褪色,停止滴定;
故答案為:溶液顏色由無色變紅,且半分鐘內顏色不變;
(3)①堿式滴定管用蒸餾水洗凈后,未經標準液潤洗就注入標準NaOH溶液,標準NaOH溶液被稀釋,導致V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(待測)偏大,故①錯誤;
②用酸式滴定管取用待測液前,尖嘴部位有氣泡,取用過程中氣泡消失,待測液的物質的量偏小,導致V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(待測)偏小,故②正確;
③滴定前,讀堿式滴定管液體體積時仰視液面,滴定后讀堿液體積時,俯視液面,導致V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(待測)偏小,故③正確;
④錐形瓶未用待測液潤洗,待測液的物質的量不變,無影響,故④錯誤;
⑤滴定過程中振蕩時有液滴濺出,待測液的物質的量偏小,導致V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(待測)偏小,故⑤正確,
故答案為:②③⑤;
(4)若實驗取待測液體積為20.00mL,堿式滴定管初讀數為0.00mL,終點時讀數為20.40mL;
答案為:20.40;
(5)若滴定到終點時不慎多滴了一滴NaOH溶液,即0.05mL,此時溶液體積為50mL,反應后溶液中c(OH-)=0.1mol•L-1×$\frac{0.05}{50}$=10-4mol•L-1,根據c(H+)c(OH-)=10-14,則c(H+)=10-10mol/L,所以pH=10,
故答案為:10.
點評 本題主要考查了中和滴定操作、誤差分析以及計算,題目難度中等,理解中和滴定的原理是解題關鍵,注意酸、堿的混合計算中,抓住過量的計算,側重于考查學生的實驗能力和數據處理能力.


科目:高中化學 來源: 題型:選擇題
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C的生成速率與C的分解速率相等 | |
| B. | 單位時間內amol A生成,同時生成3amol B | |
| C. | 容器內的壓強不再變化 | |
| D. | 混合氣體的平均相對分子質量不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | 待測鹽酸體積(mL) | 滴入Na2CO3溶液體積(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(終讀數) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:
某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:| 滴定次數 | 標準鹽酸體積/mL | 待測液體積/mL | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com