
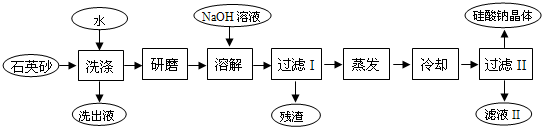
分析 向海邊的石英砂(含氯化鈉、氧化鐵等雜質)中加入水,NaCl溶于水,Fe2O3、SiO2不溶于水,然后過濾,將難溶物研磨,然后加入NaOH溶液,SiO2屬于酸性氧化物,能溶解SiO2生成Na2SiO3,Fe2O3不溶于NaOH溶液,過濾得到的殘渣為Fe2O3,將濾液蒸發濃縮、冷卻結晶,過濾后得到硅酸鈉晶體,濾液中含有部分硅酸鈉和NaOH,
(1)石英砂(含氯化鈉、氧化鐵等雜質)水洗滌得到洗出液,中主要是氯化鈉溶液,氯化鈉溶解度隨溫度變化不大,可以利用蒸發結晶的方法得到溶質;
(2)將洗凈的石英砂研磨成粉末是增大接觸面積,加快反應速率,提高生產效率;
(3)蒸發時用到的硅酸鹽儀器是玻璃、陶瓷儀器,主要有蒸發皿,玻璃棒、酒精燈;
(4)加入氫氧化鈉溶液是為了溶解二氧化硅除去;
解答 解:(1)石英砂(含氯化鈉、氧化鐵等雜質)水洗滌得到洗出液,中主要是氯化鈉溶液,氯化鈉溶解度隨溫度變化不大,可以利用蒸發結晶的方法得到溶質;冷卻結晶適用于溶解度隨溫度變化大的物質,BCD不符合,故答案為:A.
(2)要將洗凈的石英砂研磨成粉末是增大接觸面積,加快反應速率,提高生產效率;
A、固體物質無難度變化,故A錯誤;
B、不是催化劑的載體,故B錯誤;
C、增加反應物之間的接觸面積,增大反應速率,提高生產效率,故C正確;
D、正逆反應速率都增大,但不影響平衡,故D錯誤;
故答案為:C.
(3)蒸發時用到的硅酸鹽儀器是玻璃儀器和陶瓷儀器有蒸發皿,酒精燈,玻璃棒;
故答案為:蒸發皿,酒精燈,玻璃棒;
(4)上流程中加入NaOH溶液是為了溶解二氧化硅除去雜質,反應的離子方程式:SiO2+2OH-=SiO32-+H2O;
故答案為:SiO2+2OH-=SiO32-+H2O.
點評 本題考查了物質制備的流程分析和過程反應,鹽類水解的應用,實驗儀器的選擇和組成分析,化學反應速率的影響因素,題目難度中等.


科目:高中化學 來源: 題型:解答題
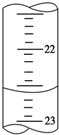 某課外活動小組欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀鹽酸,其操作步驟如下:
某課外活動小組欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀鹽酸,其操作步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
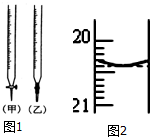 某校化學興趣小組采用酸堿中和滴定法用0.1000mol/LNaOH溶液滴定待測鹽酸溶液,試回答下面的問題:
某校化學興趣小組采用酸堿中和滴定法用0.1000mol/LNaOH溶液滴定待測鹽酸溶液,試回答下面的問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
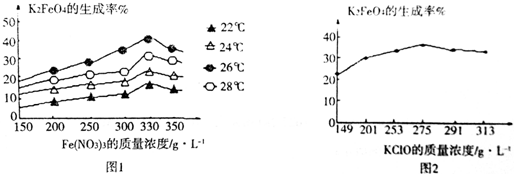
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
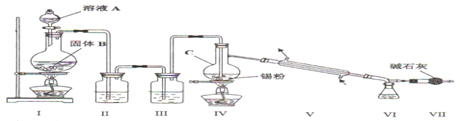
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體積相同、濃度均為0.1 mol•L-1的NaOH溶液、氨水,分別稀釋m倍、n倍,溶液的pH都變成9,則m<n | |
| B. | 有甲、乙兩氨水溶液,測得甲的pH=a,乙的pH=a+1,則甲乙兩溶液c(H+)之比為10:1 | |
| C. | 相同溫度下,0.2 mol•L-1乙酸溶液與0.1 mol•L-1乙酸溶液中c(H+)之比為2:1 | |
| D. | 已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,K變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
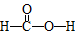 ,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體.甲酸在濃硫酸作用下容易分解產生CO.某化學興趣小組的同學對HCOOH的性質進行了以下探究:
,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體.甲酸在濃硫酸作用下容易分解產生CO.某化學興趣小組的同學對HCOOH的性質進行了以下探究: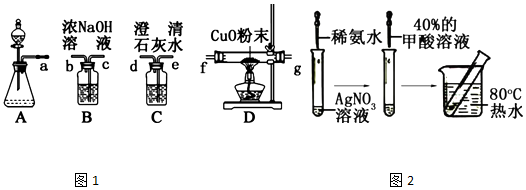
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com