
分析 (1)利用已知反應,據蓋斯定律將已知反應相加減改寫為目標方程式,計算反應熱和書寫熱化學方程式;
(2)①原電池中失電子的電極是負極,負極失電子發生氧化反應,正極上氧化劑得電子發生還原反應;
②計算出氧氣的物質的量即可求出轉移電子數;
③根據放電時的正極反應來確定正極附近溶液的氫氧根離子濃度的變化.
解答 解:(1)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2 220.0kJ/mol
②H2O(l)═H2O(g)△H2=44.0kJ/mol
據蓋斯定律①+-4×②得:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol
故答案為:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol
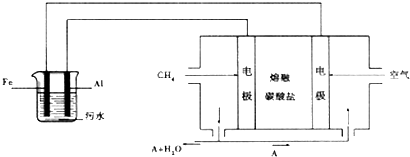
(2)①甲烷燃料電池中,甲烷在負極失電子生成碳酸根離子,氧氣在正極得電子,電極反應式為:O2+4e-+2H2O═4OH-,
故答案為:CH4-8e-+10OH-=CO32-+7H2O;
②5.6L 氧氣的物質的量為:$\frac{5.6L}{22.4L/mol}$═0.25mol,根據電極反應:O2+4e-+2H2O═4OH-,消耗5.6L(標準狀況下)O2時,轉移電子數為:0.25mol×4═1mol,
故答案為:1;
③開始放電時,正極上是氧氣發生得電子得還原反應,即O2+4e-+2H2O═4OH-,產生氫氧根,在該極附近溶液氫氧根離子濃度增大,
故答案為:增大.
點評 本題考查了蓋斯定律的應用和燃料電池,明確原電池正負極上發生的反應是解本題關鍵,注意根據電極方程式計算轉移的電子的量,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 加壓后,該反應平衡向左移 | B. | 加壓后,c(I2)增大 | ||
| C. | 壓強變化時,c(HI)不變 | D. | 加壓后,顏色變淺 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在多電子的原子里,能量高的電子通常在離核近的區域活動 | |
| B. | 核外電子總是先排在能量低的電子層上 | |
| C. | 兩種微粒,若核外電子排布完全相同,則其化學性質一定相同 | |
| D. | 微粒的最外層只能是8個或2個電子才穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用氮氣、氫氣在一定條件下生成氨氣這一可逆反應來合成氨,是一個重要的化工反應.常用來生產液氨和氨水.
利用氮氣、氫氣在一定條件下生成氨氣這一可逆反應來合成氨,是一個重要的化工反應.常用來生產液氨和氨水.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨生產過程中將NH3液化分離,會降低反應速率,但可提高N2、H2的轉化率 | |
| B. | 從海水提取鎂的過程中,電解熔融的MgO制備Mg | |
| C. | 合成氨工業溫度選擇為450℃,主要是為了提高化學反應速率 | |
| D. | 電解飽和食鹽水制燒堿時,應在陰極室加入飽和NaCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaOH溶液中逐滴滴入飽和氯化鐵溶液來制備Fe(OH)3膠體 | |
| B. | 向Fe(OH)3膠體中逐滴滴入稀鹽酸,現象是先出現紅褐色沉淀,后溶解轉為黃色溶液 | |
| C. | “丁達爾”效應是區分膠體和溶液的唯一手段 | |
| D. | 靜電除塵與膠體性質無關 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com