
| 相對分子質量 | 沸點(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
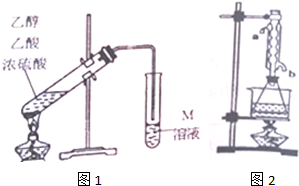
分析 (1)碎瓷片的存在可以防止在加熱過程中產生暴沸現象,補加碎瓷片時需要待已加熱的試液冷卻后再加入;
(2)試管中M溶液用于吸收乙酸乙酯,通常使用碳酸鈉溶液;由于乙醇和乙酸易溶于碳酸鈉溶液,所以導管插入溶液中易發生倒吸現象;
(3)將試管改成圓底燒瓶,然后加裝溫度計控制溫度,提高乙酸乙酯的產率;
(4)根據冷凝器采用逆向通水效果好完成;根據利用實驗①、②測量的數據及反應原理計算出粗產物中乙酸乙酯的質量分數.
解答 解:(1)缺少碎瓷片會發生暴沸現象,如果加熱一段時間后發現忘記加瓷片,應該待溶液冷卻后再加入,所以C正確,
故答案為:C;
(2)乙酸乙酯在碳酸鈉溶液中的溶解度較小,且碳酸鈉溶液能夠吸收乙酸、溶解乙醇,所以M為Na2CO3;由于乙酸和乙醇都易溶于Na2CO3溶液,則試管中容易發生倒吸現象,
故答案為:Na2CO3;乙酸和乙醇都易溶于Na2CO3溶液;
(3)在乙酸乙酯的制取過程中,乙醇和乙酸能夠揮發出來,影響了乙酸乙酯的產率,可以加裝水冷凝管,提高冷卻效果,也可以用圓底燒瓶替代試管并加裝溫度計控制反應溫度的方法,通過乙酸乙酯的產率,
故答案為:加裝水冷凝管,提高冷卻效果;用圓底燒瓶(或三頸瓶)并加裝溫度計控制反應溫度(其它合理答案也給分).
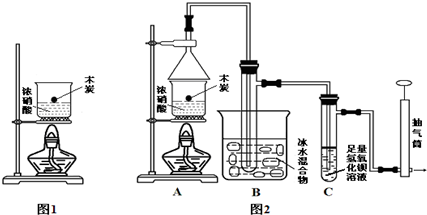
(4)冷凝器采用逆向通水,使水與冷凝的氣體充分接觸,冷凝效果好,故從b通水,
由①可知,與氫氧化鈉反應的是乙酸乙酯中的雜質乙酸,所以20g乙酸乙酯粗品中含有乙酸的物質的量為:0.50mol•L-1×0.04L=0.02mol,
根據②可知,乙酸乙酯水解生成的乙酸和雜質乙酸消耗的氫氧化鈉的物質的量為:2.1mol•L-1×0.1L-0.50mol•L-1×0.02L=0.20mol,
乙酸乙酯水解生成的乙酸的物質的量為:0.20mol-0.02mol=0.18mol,
乙酸乙酯的物質的量等于乙酸的物質的量,所以20g乙酸乙酯粗品中含有乙酸乙酯的質量為:88g/mol×0.18g=15.84g,
乙酸乙酯的質量分數為:$\frac{15.84g}{20g}$×100%=79.2%,
故答案為:b;79.2%.
點評 本題考查了乙酸乙酯的制取,題目難度中等,注意掌握乙酸乙酯的反應原理及裝置選擇,試題在注重對學生基礎知識訓練和檢驗的同時,側重對學生實驗答題能力的培養和方法與技巧的指導和訓練,有利于提高學生的實驗設計能力和應試能力,提升學生的學科素養.


科目:高中化學 來源: 題型:選擇題
| A. | SiO2+4HF=SiF4↑+2H2O;用氫氟酸蝕刻玻璃 | |
| B. | 4Na+TiCl4 $\frac{\underline{\;高溫\;}}{\;}$4NaCl+Ti;用金屬鈉與熔融TiCl4反應制取金屬Ti | |
| C. | CO32-+H2O?H2CO3+OH-;用熱的純堿溶液清洗餐具油污 | |
| D. | MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑;工業上用電解熔融氯化鎂制取金屬鎂 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 84 g NaHCO3晶體中含有NA個CO32- | |
| B. | 室溫下,14.0 g乙烯和丁烯的混合氣體中含有C-H鍵數目為2.0NA | |
| C. | 電解精煉銅時,若陽極質量減少6.4 g,則電路中轉移電子數為0.2NA | |
| D. | 78 g Na2O2與足量的CO2反應,電子轉移個數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 容積 | 容積/L | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學式 | 電離常數 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
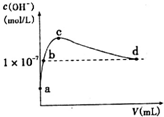 常溫下,向l L pH=l0的NaOH溶液中持續通入CO2.通入CO2的體積(y)與溶液中水電離出的c(OH-)的關系如圖所示.下列敘述錯誤的是( )
常溫下,向l L pH=l0的NaOH溶液中持續通入CO2.通入CO2的體積(y)與溶液中水電離出的c(OH-)的關系如圖所示.下列敘述錯誤的是( )| A. | a點溶液中:水電離出的c(H+)=1×10-10mol•L-1 | |
| B. | b點溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c點溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d點溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com