
分析 (1)質子數與中子數相等的同位素,計算得到質量數=15+15=30,結合原子符號書寫核素;
(2)①酸性氧化物是能和堿反應生成鹽和水的氧化物,非金屬氧化物中非金屬化合價和酸中元素化合價相同,結合氧化還原反應電子守恒計算電子轉移;
②黃磷(P4)有毒,它能將金、銀、銅從其冷的鹽溶液中還原出來.寫出黃磷與冷硫酸銅溶液反應生成銅,磷酸和硫酸,結合原子守恒配平書寫化學方程式;
(3)依據同主族非金屬性的強弱分析判斷氫化物的穩定性,實質是原子結構的特征分析,原子核對最外層電子的吸引力判斷;
(4)①磷酸鈉的水溶液顯堿性是因為磷酸根離子分步水解,溶液中水的電離被促進氫氧根離子濃度增大;
②K1=7.5×10-3,K2=6.2×10-8,K3=2.2×10-13,則NaH2PO4溶液中分析計算H2PO4-的水解常數,和H2PO4-的電離程度比較分析判斷溶液酸堿性;
解答 解:(1)質子數與中子數相等的同位素,計算得到質量數=15+15=30,結合原子符號書寫核素為:3015P,
故答案為:3015P;
(2)①酸性氧化物是能和堿反應生成鹽和水的氧化物,非金屬氧化物中非金屬化合價和酸中元素化合價相同,反應2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10;10C+P4O10=P4↑+10CO↑中,二氧化硅是硅酸的酸酐,P4O10是磷酸的酸酐,結合氧化還原反應電子守恒計算電子轉移,每生成1mol P4時碳元素化合價0價變化為+2價,磷元素化合價變化為+5價,電子轉移為20mol,
故答案為:20;
②黃磷(P4)有毒,它能將金、銀、銅從其冷的鹽溶液中還原出來.寫出黃磷與冷硫酸銅溶液反應生成銅,磷酸和硫酸,結合原子守恒配平書寫化學方程式為:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案為:SiO2、P4O10;P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4;
(3)依據同主族非金屬性的強弱分析判斷氫化物的穩定性,實質是原子結構的特征分析,原子核對最外層電子的吸引力判斷,N、P同主族最外層電子數相同,P的電子層數比N多,原子核對電子的吸引力弱,故磷化氫的穩定性較差:PH3<NH3,
故答案為:<,N、P同主族最外層電子數相同,P的電子層數比N多,原子核對電子的吸引力弱,故磷化氫的穩定性較差;
(4)①磷酸鈉的水溶液顯堿性是因為磷酸根離子分步水解,溶液中水的電離被促進氫氧根離子濃度增大,水解離子方程式為:PO43-+H2O?HPO42-+OH-;
②K1=7.5×10-3,K2=6.2×10-8,K3=2.2×10-13,NaH2PO4溶液中分析計算H2PO4-的水解常數,和H2PO4-的電離程度比較分析判斷溶液酸堿性,Kh(H2PO4-)=$\frac{c({H}_{3}P{O}_{4})c(O{H}^{-})}{{c(H}_{2}P{{O}_{4}}^{-})}$=$\frac{Kw}{{K}_{1}}$=$\frac{1×1{0}^{-14}}{7.5×1{0}^{-3}}$=1.33×10-10<K2,H2PO4-的電離強于水解,溶液中c(H+)>c(OH-),溶液顯酸性,
故答案為:酸,Kh(H2PO4-)=$\frac{c({H}_{3}P{O}_{4})c(O{H}^{-})}{{c(H}_{2}P{{O}_{4}}^{-})}$=$\frac{Kw}{{K}_{1}}$=$\frac{1×1{0}^{-14}}{7.5×1{0}^{-3}}$=1.33×10-10<K2,H2PO4-的電離強于水解,溶液中c(H+)>c(OH-),溶液顯酸性.
點評 本題考查了磷奇跡化合物性質的分析判斷,主要是氧化還原反應電子轉移和化學方程式書寫,弱電解質電離平衡,鹽類水解平衡的理解應用,掌握基礎是關鍵,題目難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題

 ,肉桂醛分子結構中有6種不同化學環境的氫原子.
,肉桂醛分子結構中有6種不同化學環境的氫原子.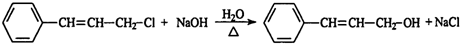 ,B轉化為肉桂醛的反應條件為Cu/Ag加熱.
,B轉化為肉桂醛的反應條件為Cu/Ag加熱. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 最新的數據顯示,北京霧霾顆粒中機動車尾氣占22.2%,燃煤占16.7%,揚塵占16.3%,工業占15.7%.據分析六大主要霧霾貢獻源如圖所示.下列措施不可能改善空氣質量的是( )
最新的數據顯示,北京霧霾顆粒中機動車尾氣占22.2%,燃煤占16.7%,揚塵占16.3%,工業占15.7%.據分析六大主要霧霾貢獻源如圖所示.下列措施不可能改善空氣質量的是( )| A. | 應用高效潔凈的能源轉換技術,在大型燃煤鍋爐上安裝低氮燃燒器,采用煙氣脫硝技術 | |
| B. | 不放煙花焰火,加強道路揚塵污染控制,強化路面保潔,灑水防塵 | |
| C. | 在煉油廠.鋼鐵廠.發電廠等,推廣和使用脫硫技術,降低硫氧化物的排放 | |
| D. | 研究采煤.采油新技術,增加汽油.柴油等能源的供應量,提倡以汽車代步的現代消費與生活理念 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=4的氯化銨溶液,用蒸餾水稀釋10倍后,溶液的pH=5 | |
| B. | pH=3的鹽酸與pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液與pH=12的NaOH溶液以體積比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO兩種溶液中水的電離程度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
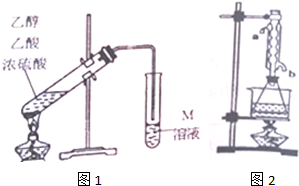
| 相對分子質量 | 沸點(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應速率是表示化學反應快慢的物理量 | |
| B. | 一般情況下,升高溫度能加快化學反應速率 | |
| C. | 可逆反應達到化學反應限度時,反應就靜止不動了 | |
| D. | 可逆反應達到化學反應限度時,正反應速率等于逆反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com