
| A. | 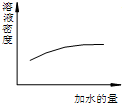 濃硫酸的稀釋 濃硫酸的稀釋 | |
| B. | 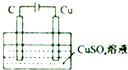 某電極上有銅產生,且溶液中銅離子濃度不變 | |
| C. |  微粒電子數 微粒電子數 | |
| D. | 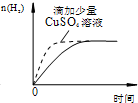 過量的鹽酸和等量的鋅粉反應 過量的鹽酸和等量的鋅粉反應 |
分析 A.濃硫酸濃度越大其密度越小;
B.電解時,陽極上氫氧根離子放電生成氧氣、陰極上銅離子放電生成Cu;
C.分子、原子或基團中電子數=質子數,陽離子中電子數=質子數-電荷數,陰離子中電子數=質子數+電荷數;
D.鋅和銅離子發(fā)生置換反應生成Cu,Cu、Zn和稀鹽酸構成原電池,原電池加快反應速率.
解答 解:A.濃硫酸濃度越大其密度越小,所以濃硫酸密度隨著溶液的稀釋而減小,故A錯誤;
B.電解時,陽極上氫氧根離子放電生成氧氣、陰極上銅離子放電生成Cu,溶液中銅離子濃度降低,故B錯誤;
C.分子、原子或基團中電子數=質子數,水分子、羥基中電子數分別是10、9,陽離子中電子數=質子數-電荷數,則水和氫離子中電子數是10,陰離子中電子數=質子數+電荷數,氫氧根離子中電子數是10,故C正確;
D.鋅和銅離子發(fā)生置換反應生成Cu,Cu、Zn和稀鹽酸構成原電池,原電池加快反應速率,鋅和銅反應導致生成氫氣的量減少,故D錯誤;
故選C.
點評 本題考查圖象分析,側重考查學生分析判斷能力,涉及原電池和電解池原理、電子數的計算、溶液密度與濃度關系,注意電解池中活潑金屬作陽極時金屬失電子而不是電解質溶液中陰離子失電子,易錯選項是D,如果將題改為“等量的稀鹽酸和足量鋅反應”時該圖象就正確,注意仔細審題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1 mol•L-1的FeCl3溶液中,Fe3+離子個數小于NA | |
| B. | Al3+和S2-,NO3-和S2-兩組離子在酸、堿和中性溶液中均不能大量共存 | |
| C. | Ca(HCO3)2溶液與過量NaOH溶液反應的離子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| D. | 向10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1鹽酸時,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
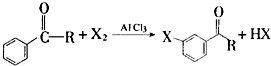


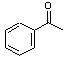 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr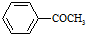 的符合以下條件的同分異構體還有4種(不包括原料本身),條件:結構中必須含有苯環(huán)和
的符合以下條件的同分異構體還有4種(不包括原料本身),條件:結構中必須含有苯環(huán)和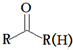 ,其中核磁共振氫譜圖中共有5個吸收峰的分子的結構簡式為
,其中核磁共振氫譜圖中共有5個吸收峰的分子的結構簡式為
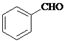 )和乙醇為原料合成苯乙酸乙酯,如圖
)和乙醇為原料合成苯乙酸乙酯,如圖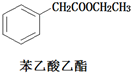 :
:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 化學式為C6H6O6 | |
| B. | 烏頭酸能使酸性高錳酸鉀溶液或溴水褪色 | |
| C. | 烏頭酸能發(fā)生水解反應和加成反應 | |
| D. | 含l mol烏頭酸的溶液最多可消耗3 mol NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)CH3+、-CH3(甲基)、CH3-都是重要的有機反應中間體,有關它們的說法正確的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有機反應中間體,有關它們的說法正確的是CDE.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HD、H2O、NH3均為化合物 | |
| B. | CH2O2、C3H6O2、C4H8O2一定互為同系物 | |
| C. | HCOOCH3、CH3COOH、HOCH2CHO互為同分異構體 | |
| D. | SiO2、NaCl、S8、Cu均是能表示物質分子組成的分子式 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 濃氨水和濃HNO3 | B. | 濃氨水和濃鹽酸 | C. | 濃氨水和濃H2SO4 | D. | 濃氨水和濃H3PO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com