
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙變紅色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水電離出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
分析 A.次氯酸根離子能夠氧化亞鐵離子、碘離子;
B.該溶液為酸性溶液,四種離子之間不反應,都不與氫離子反應;
C.溶液中偏鋁酸鈉與氫離子反應;
D.水電離出的c(OH-)=1×10-12mol•L-1的溶液為酸性或堿性溶液,銨根離子與氫氧根離子反應,碳酸氫根離子與氫離子和氫氧根離子反應.
解答 解:A.ClO-具有較強的氧化性,能與Fe2+、I-等還原性離子發生氧化還原反應,溶液中不能共存,故A錯誤;
B.甲基橙變紅色的溶液呈酸性,Mg2+、K+、SO42-、NO3-之間不發生反應,都不與酸性溶液中的氫離子反應,在溶液中能夠大量共存,故B正確;
C.0.1 mol•L-1NaAlO2溶液中,H+離子與NaAlO2反應,在溶液中不能大量共存,故C錯誤;
D.由水電離出的c(OH-)=1×10-12mol•L-1,該溶液中水的電離受到抑制,為酸性或堿性溶液,NH4+、HCO3-都能夠與堿溶液反應,HCO3-能夠與酸反映,在溶液中不能大量共存,故D錯誤;
故選B.
點評 本題考查離子共存的正誤判斷,為中等難度的試題,注意明確離子不能大量共存的一般情況:能發生復分解反應的離子之間,能發生氧化還原反應的離子之間等;還應該注意題目所隱含的條件,如:溶液的酸堿性,據此來判斷溶液中是否有大量的 H+或OH-;是“可能”共存,還是“一定”共存等.


科目:高中化學 來源: 題型:選擇題
| A. | 硫酸、純堿、偏鋁酸鈉和過氧化鈉分別屬于酸、堿、鹽和氧化物 | |
| B. | 乙醇、次氯酸鈉和二氧化硫分別屬于非電解質、強電解質和弱電解質 | |
| C. | Na、Al、Cu通常分別用電解法、熱分解法和置換法冶煉得到 | |
| D. | 天然氣、沼氣和水煤氣分別屬于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
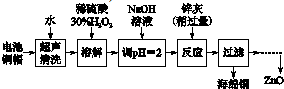
| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
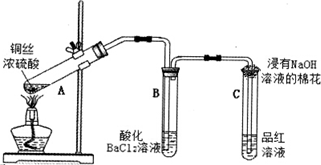
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
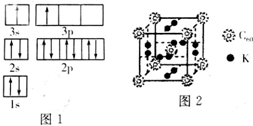 納米技術制成的金屬燃料、非金屬固體燃料等已應用到社會生活和高科技領域.單位質量的A和B單質燃燒時均放出大量熱,可用作燃料.已知A和B均為短周期元素,其原子的第一至第四電離能如下表所示:
納米技術制成的金屬燃料、非金屬固體燃料等已應用到社會生活和高科技領域.單位質量的A和B單質燃燒時均放出大量熱,可用作燃料.已知A和B均為短周期元素,其原子的第一至第四電離能如下表所示:| 電離能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
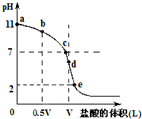 常溫時向濃度為0.1mol/L體積為VL的氨水中逐滴加入一定濃度的鹽酸,用pH計測得溶液的pH隨鹽酸的加入量而降低的滴定曲線,d點兩種溶液恰好完全反應.根據圖象回答下列問題:
常溫時向濃度為0.1mol/L體積為VL的氨水中逐滴加入一定濃度的鹽酸,用pH計測得溶液的pH隨鹽酸的加入量而降低的滴定曲線,d點兩種溶液恰好完全反應.根據圖象回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com