
 電化學原理在醫學醫療中有重要應用.
電化學原理在醫學醫療中有重要應用.分析 (1)依據蓋斯定律計算反應熱,根據碘在反應中化合價降低,反應還原反應來分析;
(2)①電解池的陰極連接電源的負極,根據電解產物判斷;
②陽極室中發生的反應依次為:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③根據電極方程式計算,有關反應有為陰極反應為:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),陽極反應為:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
解答 解:(1)①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
依據蓋斯定律$\frac{(①-②)}{2}$得:2Li(s)+I2(s)═2LiI(s),所以△H=$\frac{1}{2}$(△H1-△H2);碘在反應中化合價降低,反應還原反應,在正極放電,
故答案為:$\frac{1}{2}$(△H1-△H2);正;
(2)①根據電解池中陰離子在陽極放電和陽離子在陰極放電的規律及本題圖中的電極產物H2和Cl2,可以判斷出A為電源的正極,B為電源的負極,
故答案為:B;
②陽極首先發生氧化反應生成氯氣,氯氣和尿素反應生成氮氣、二氧化碳和氯化氫,陽極室中發生的反應依次為:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案為:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③陰極反應為:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)
陽極反應為:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根據上述反應式可以看出在陰、陽極上產生的OH-、H+的數目相等,陽極室中反應產生的H+通過質子交換膜進入陰極室與OH-恰好反應生成水,所以陰極室中電解前后溶液的pH不變;
由上述反應式可以看出,轉移6mole-時,陰極產生3molH2,陽極產生1molN2和1molCO2,故電解收集到的11.2 L氣體中,V(N2)=V(CO2)=$\frac{11.2L}{5}$=2.24L,
即n(N2)=n(CO2)=0.1 mol,根據方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.1 mol N2所消耗的CO(NH2)2的物質的量也為0.1 mol,其質量為:m[CO(NH2)2]=0.1 mol×60 g•mol-1=6.0 g,
故答案為:不變;6.0.
點評 本題考查了蓋斯定律及其電解原理知識,包括電極產物的判斷、電解原理及其應用等,解答電解原理試題時,首先要注意陽極材料,若陽極材料為除Au、Pt之外的金屬,則陽極金屬先失去電子,若陽極材料為惰性電極,熟記陰陽離子的放電順序是解題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 澄清石灰水與稀硝酸反應 | B. | 硫在氧氣中燃燒 | ||
| C. | 鈉粒與稀鹽酸反應 | D. | 碳酸氫鈉溶液與氫氧化鈉溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
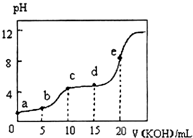 常溫下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲線如圖所示.下列敘述正確的是( )
常溫下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲線如圖所示.下列敘述正確的是( )| A. | a點所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c點所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e點所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五個點中d點時c(HR-)最大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
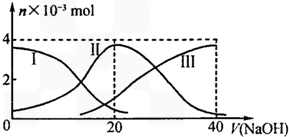 25℃時,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有關微粒物質的量變化如圖(其中I代表H2A,II代表HA-,III代表A2-).根據圖示判斷下列說法正確的是( )
25℃時,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有關微粒物質的量變化如圖(其中I代表H2A,II代表HA-,III代表A2-).根據圖示判斷下列說法正確的是( )| A. | 等體積等濃度的NaOH溶液與H2A溶液混合后,其溶液中水的電離程度比純水大 | |
| B. | 向Na2A溶液加入水的過程中,pH可能增大也可能減小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 當V(NaOH)=20mL時,溶液中離子濃度大小關系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后鹽水解使溶液呈堿性 | B. | 弱酸溶液和強堿溶液反應 | ||
| C. | 強酸溶液和弱堿溶液反應 | D. | 一元強酸溶液和一元強堿溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
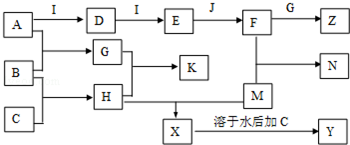
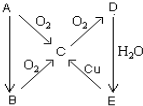 A、B、C、D、E、在一定條件下的轉換條件如圖所示.
A、B、C、D、E、在一定條件下的轉換條件如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
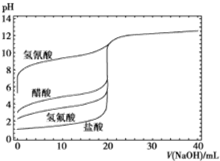 如圖是用0.1mol/LNaOH溶液分別滴定20mL濃度均為0.1mol/L的不同一元酸的滴定曲線,下列說法錯誤的是( )
如圖是用0.1mol/LNaOH溶液分別滴定20mL濃度均為0.1mol/L的不同一元酸的滴定曲線,下列說法錯誤的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸時,應用酚酞做指示劑不能使用甲基橙 | |
| C. | 當加入10mLNaOH溶液時,c(CN-)>c(CH3COO-) | |
| D. | 隨NaOH溶液的滴入,CH3COOH溶液中水的電離程度先變大后變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com