
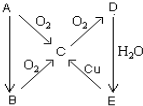
 A、B、C、D、E、在一定條件下的轉換條件如圖所示.
A、B、C、D、E、在一定條件下的轉換條件如圖所示.分析 根據題中各物質的轉化關系,(1)若A在常溫下為固態單質,C為能使品紅溶液褪色的氣體,即為SO2,則A為S,B為H2S,C為,D為SO3,E為濃硫酸,(2)若A在常溫下為氣態單質,則由轉化關系可知,A為N2,B為NH3,C為NO,D為NO2,E為稀硝酸,以此來解答.
解答 解:根據題中各物質的轉化關系,
(1)若A在常溫下為固態單質,C為能使品紅溶液褪色的氣體,即為SO2,則A為S,B為H2S,C為,D為SO3,E為濃硫酸,
C→D變化的化學方程式為 2SO2+O2$?_{△}^{催化劑}$2SO3,
E→C變化的化學方程式為Cu+2H2SO4(濃)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案為:2SO2+O2$?_{△}^{催化劑}$2SO3;Cu+2H2SO4(濃)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)若A在常溫下為氣態單質,則由轉化關系可知,A為N2,B為NH3,C為NO,D為NO2,E為稀硝酸,A→B變化的化學方程式為N2+3H2$?_{催化劑}^{高溫、高壓}$2NH3,
故答案為:N2;NO2;N2+3H2$?_{催化劑}^{高溫、高壓}$2NH3.
點評 本題考查無機物的推斷,為高頻考點,把握物質的性質及相互轉化為解答的關鍵,側重N、S及其化合物性質的考查,注意連續氧化的特點,題目難度不大.


科目:高中化學 來源: 題型:解答題
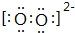 .
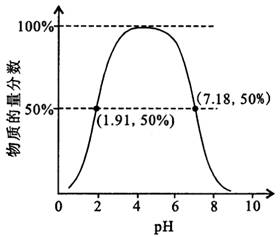
. 
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 金屬離子 | PH值 | |
| 開始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 電化學原理在醫學醫療中有重要應用.
電化學原理在醫學醫療中有重要應用.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
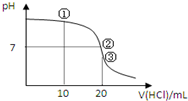 常溫下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲線如圖.下列說法正確的是( )
常溫下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲線如圖.下列說法正確的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定過程中可能出現:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 物質 | 試劑 | 除雜方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
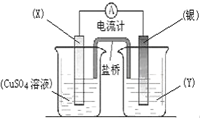 依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.
依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO(g)+H2(g).
CO(g)+H2(g).| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com