
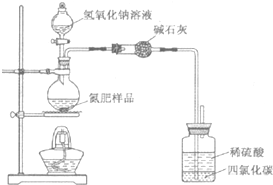
 某氮肥硫酸銨中混有硫酸氫銨.為測定該氮肥的含氮量,一化學研究性學習小組取一定量氮肥樣品,研磨使其混合均勻,備用.已知:
某氮肥硫酸銨中混有硫酸氫銨.為測定該氮肥的含氮量,一化學研究性學習小組取一定量氮肥樣品,研磨使其混合均勻,備用.已知:| 氫氧化鈉溶液/mL | 40.00 | ||
| 樣品質量/g | 7.750 | 15.50 | 23.25 |
| 氨氣質量/g | 1.870 | 1.870 | 1.700 |
分析 (1)①堿石灰用于干燥氨氣;
②氨氣極易溶于水,容易發生倒吸現象;
③反應生成的氨氣不能夠被稀硫酸完全吸收;
(2)①根據實驗數據,判斷出第一組實驗中氫氧化鈉過量,所有的銨離子都生成了氨氣,根據氮原子守恒列式計算出樣品中氮元素的質量分數;
②根據第一組數據計算出硫酸銨和硫酸氫銨的含量,再根據第二組中所有的氫氧化鈉都參與了反應,即氫氧化鈉不足,計算出氫氧化鈉的濃度;
③根據氫氧化鈉的物質的量和樣品中硫酸氫鈉的物質的量,計算出生成的氨氣的物質的量及質量.
解答 (1)①生成的氨氣中含有水分,用堿石灰吸收氨氣中的水分,
故答案為:吸收氨氣中的水蒸氣;
②氨氣極易溶于水,容易發生倒吸,所以廣口瓶內四氯化碳用于防止倒吸,
故答案為:防止倒吸;
③用該裝置進行實驗,即使氫氧化鈉足量且實驗過程中無氨氣外泄,由于裝置內的氨氣不能完全被稀硫酸吸收,測得的樣品含氮量仍將偏低,
故答案為:殘留在反應裝置中的氨氣未被稀硫酸吸收;
(2)①設氮肥硫酸銨的質量分數為X,則硫酸氫銨的質量分數為(1-X),
從實驗方案的數據看出,第一個實驗和第二個實驗中生成的氨氣質量相同,說明第一個實驗中氫氧化鈉是過量的,所有銨離子都生產了氨氣,根據氮元素守恒,$\frac{7.75×X}{132}$×17+$\frac{7.75×(1-X)}{115}$=1.87
解得:X=0.85,
即氮肥中硫酸銨的質量分數為85%,硫酸氫銨的質量分數為15%,
根據氮原子守恒:氮原子的物質的量就等于氨氣的物質的量,
所以樣品中氮元素的質量分數為:$\frac{\frac{1.87}{17}×14}{7.75}$×100%=19.87%,
故答案為:19.87;
②假如第二個實驗方案中氫氧化鈉是過量的,則生成氨氣質量為:$\frac{15.50×0.85}{132}$+$\frac{15.50×0.15}{115}$≈3.74g>1.87g,
這說明第二個實驗方案中,氫氧化鈉的物質的量不足,氫氧化鈉反應完硫酸氫銨中的氫離子后全部生成硫酸銨,剩余的氫氧根離子不足以將全部銨根離子反應溢出,而是只反應了一部分硫酸銨,放出了1.87g氨氣;
根據反應方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,
加入的氫氧化鈉的物質的量為:n(NH4HSO4)+n(NH3)=$\frac{15.5×0.15}{115}$mol+$\frac{1.87}{17}$mol≈0.13mol,
氫氧化鈉溶液的濃度為:$\frac{0.13mol}{0.04L}$=3.25mol/L,
故答案為:3.25;
③若樣品質量為31g,則加入的氫氧化鈉物質的量還是0.13mol,
根據反應方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,
反應中硫酸氫銨消耗的氫氧化鈉的物質的量為:$\frac{31×0.15}{115}$mol=0.04mol,
剩下的氫氧化鈉物質的量為:0.13mol-0.04mol=0.09mol,
根據反應方程式:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,生成的氨氣的物質的量為:0.09mol,
所以生成的氨氣的質量為:17g/mol×0.09mol=1.53g,
故答案為:1.53.
點評 本題考查了測定氮肥硫酸銨中氮元素的含量,題目計算量比較大,需要合理分析、應用題中實驗數據,得出正確結論,本題充分考查了所學的分析、理解和綜合計算能力,本題難度稍大.


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用食醋除去暖水瓶中的薄層水垢 | |
| B. | 用米湯檢驗食鹽中是否含碘酸鉀(KIO3) | |
| C. | 醫用酒精的濃度通常為75%,可用于殺菌消毒 | |
| D. | 用灼燒并聞氣味的方法區別純棉織物和純羊毛織物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 保持溫度和容器壓強不變,充入1mol NH3(g) | |
| B. | 保持溫度和容器體積不變,充入1mol NH3(g) | |
| C. | 保持溫度和容器壓強不變,充入1mol N2(g) | |
| D. | 保持溫度和容器體積不變,充入1mol H2(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaAlO2溶液中通入過量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NH4HCO3溶液中加入過量氫氧化鈉溶液:NH4++OH-═NH3.H2O | |
| C. | AlCl3溶液中滴加過量氨水:Al3++3NH3.H2O═3NH4++Al(OH)3↓ | |
| D. | 磁性氧化鐵(Fe3O4)溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量白磷貯存于水中,切割時要在水下進行 | |
| B. | 液溴直接保存于磨口玻璃塞的細口棕色瓶中 | |
| C. | KOH溶液存放在磨口玻璃塞的廣口瓶中 | |
| D. | 少量金屬鈉存放在無水乙醇中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2的燃燒熱(△H)是285.8kJ•mol-1 | |
| B. | 反應2H2O(g)=2H2(g)+O2(g)H2的焓變(△H)是571.6kJ•mol-1 | |
| C. | 反應2H2O(l)=2H2(g)+O2(g)只能在電解條件下進行 | |
| D. | 反應2H2O(l)=2H2(g)+O2(g)在一定條件下可以自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 常溫常壓下,18 g水中含有的水分子數目為NA | |
| B. | 常溫常壓下,1.06g Na2CO3含有的Na+離子數為0.02 NA | |
| C. | 通常狀況下,NA 個CO2分子占有的體積為22.4L | |
| D. | 物質的量濃度為0.5mol/L的MgCl2溶液中,含有Cl-個數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
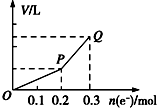 用惰性電極電解硫酸銅溶液,整個過程轉移電子的物質的量與產生氣體總體積的關系如圖所示(氣體體積均在相同狀況下測定).欲使溶液恢復到起始狀態,可向溶液中加入( )
用惰性電極電解硫酸銅溶液,整個過程轉移電子的物質的量與產生氣體總體積的關系如圖所示(氣體體積均在相同狀況下測定).欲使溶液恢復到起始狀態,可向溶液中加入( )| A. | 0.15 mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.075mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com