
分析 (1)已知:(Ⅰ) N2(g)+O2(g)?2NO(g)△H=+180.5kJ/mol
(Ⅱ)2C(s)+O2(g)?2CO(g)△H=-221.0kJ/mol
(Ⅲ)C(s)+O2(g)?CO2(g)△H=-393.5kJ/mol
根據蓋斯定律:方程式(III)×2-(I)-(II)得到方程式2NO(g)+2CO(g)?N2(g)+2CO2(g),據此計算;
(2)當△H-T△S<0,反應能自發進行;
(3)A.催化劑只影響反應速率,不會改變轉化率;
B.增大壓強平衡向逆反應方向移動;
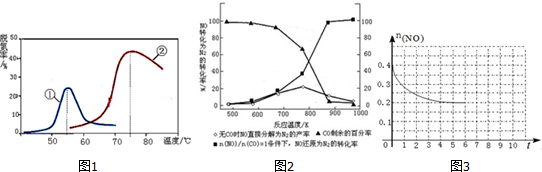
C.最高點為催化劑活性最高的溫度;
D.根據圖象判斷,脫氨率最高的點對應的溫度應是最適宜溫度;
(4)①分析圖象的曲線變化特征判斷,升高溫度,發現NO的分解率降低;
②根據圖象分析最佳溫度;
(5)已知反應為2NO(g)+2CO(g)?N2(g)+2CO2(g),2L密閉容器中充入NO、CO各0.4mol,達到平衡時NO為0.2mol,利用三段式求出平衡濃度,再根據K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$計算;第6分鐘繼續加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,根據Qc=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$計算,然后比較Qc與K的大小關系判斷移動方向,再作圖;
(6)氮的氧化物具有氧化性,要把NOx脫氮轉化成無毒的N2,需要加還原劑,據此分析.
解答 解:(1)已知:(Ⅰ) N2(g)+O2(g)?2NO(g)△H=+180.5kJ/mol
(Ⅱ)2C(s)+O2(g)?2CO(g)△H=-221.0kJ/mol
(Ⅲ)C(s)+O2(g)?CO2(g)△H=-393.5kJ/mol
根據蓋斯定律:方程式(III)×2-(I)-(II)得到方程式2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=(-393.5kJ/mol)×3-(-221.0kJ/mol)-(+180.5kJ/mol)=-746.5 kJ/mol;
故答案為:-746.5 kJ/mol;
(2)已知(Ⅳ)2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ/mol,該反應為氣體體積減少的反應,所以△S<0,若要△H-T△S<0,T的數值必須較小,即在低溫時自發進行;
故答案為:<;低溫;
(3)A.催化劑不會影響轉化率,只影響反應速率,所以第②種催化劑和第①種催化劑對轉化率沒有影響,故A錯誤;
B.反應為體積增大的反應,增大壓強平衡向逆反應方向移動,脫氮率減小,故B錯誤.
C.圖象研究的是不同催化劑在不同的溫度下的活性比較,最高點為催化劑活性最大的狀態,與平衡轉化率無關,故C錯誤;
D.兩種催化劑分別在55℃和75℃左右催化效率最高,說明此時催化劑的活性最大,故D正確;
故選:D.
(4)①升高溫度,發現NO的分解率降低,說明反應向逆反應方向進行,該反應放熱,則NO分解反應是放熱反應,升高溫度不利于反應進行;
故答案為:NO分解反應是放熱反應,升高溫度不利于反應進行;
②由圖可知,在$\frac{n(NO)}{n(CO)}$=1的條件下,870℃時,NO還原為N2的轉化率為100%,所以應控制的最佳溫度在870℃;
故答案為:870℃;
(5)已知反應為2NO(g)+2CO(g)?N2(g)+2CO2(g),2L密閉容器中充入NO、CO各0.4mol,達到平衡時NO為0.2mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始(mol):0.4 0.4 0 0
轉化(mol):0.2 0.2 0.1 0.2
平衡(mol):0.2 0.2 0.1 0.2
則K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{(\frac{0.2}{2})^{2}×(\frac{0.1}{2})}{(\frac{0.2}{2})^{2}×(\frac{0.2}{2})^{2}}$=5;
第6分鐘繼續加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,則c(NO)=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L,c(CO)=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L,
c(N2)=$\frac{0.1mol+0.3mol}{2L}$=0.2mol/L,c(CO2)=$\frac{0.2mol+0.2mol}{2L}$=0.2mol/L,
Qc=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.2×0.{2}^{2}}{0.{2}^{2}×0.{2}^{2}}$=5=K,說明是平衡狀態,所以第6分鐘繼續加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,仍是平衡狀態,但是NO的物質的量變為原來的2倍,作圖為 ;
;
故答案為: ;
;
(6)氮的氧化物具有氧化性,要把NOx脫氮轉化成無毒的N2,需要加還原劑,NH3、CH4、尿素均可作還原劑,KMnO4是常用的氧化劑,所以ABD正確;
故答案為:ABD.
點評 本題考查化學反應速率與化學平衡移動問題,化學平衡常數及影響因素、意義,反應速率計算等,難度中等,本題注意分析圖象曲線的變化趨勢,側重于考查學生的讀圖能力和分析能力.


科目:高中化學 來源: 題型:解答題
 三氯氧磷(POCl3)常溫下為無色液體,有廣泛應用.近年來,三氯氧磷的工業生產由三氯化磷的“氧氣直接氧化法”代替傳統的三氯化磷“氯化水解法”(由氯氣、三氯化磷和水為原料反應得到).
三氯氧磷(POCl3)常溫下為無色液體,有廣泛應用.近年來,三氯氧磷的工業生產由三氯化磷的“氧氣直接氧化法”代替傳統的三氯化磷“氯化水解法”(由氯氣、三氯化磷和水為原料反應得到). AgSCN(S)+Cl-(aq);該反應使測定結果偏低;(填偏高,偏低或不變)
AgSCN(S)+Cl-(aq);該反應使測定結果偏低;(填偏高,偏低或不變)查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18mol/L的濃硫酸15mL L | B. | 0.2mol/L的鹽酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的鹽酸15m |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,則反應熱的關系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,則反應熱的關系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,則物質的穩定性:SO2>SO3 | |
| D. | 若斷裂1molH2(g)中的H-H鍵、斷裂1 molO2(g)中的共價鍵分別需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O鍵能放出463kJ的能量,則2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應是復分解反應 | B. | NO發生還原反應 | ||
| C. | CO是氧化劑 | D. | 反應物中O得電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.
已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com