
分析 鋅比銅活潑,形成原電池反應時,鋅為負極,發生氧化反應,電極反應式為Zn-2e-=Zn2+,銅為正極,發生還原反應,電極反應式為2H++2e-=H2↑,結合原電池工作原理及電極反應式進行相關的計算.
解答 解:鋅比銅活潑,形成原電池反應時,鋅為負極,發生氧化反應,電極反應式為Zn-2e-=Zn2+,銅為正極,發生還原反應,電極反應式為2H++2e-=H2↑,鋅片的質量減少了6.5克,n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,銅表面析出了氫氣為0.1mol×22.4L/mol=2.24L,導線上通過0.2mol電子時,SO42-向負極移動,氫離子濃度減小,則溶液的pH值增大;用離子方程式表示電極的總反應式為Zn+2H+=Zn2++H2↑,
故答案為:2.24;0.2;負極;增大;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑.
點評 本題考查原電池知識,為高考常見題型,側重于學生的分析能力和計算能力的考查,注意把握電極反應式的書寫,題目難度不大.


科目:高中化學 來源: 題型:解答題
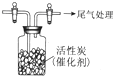 某學習小組推測SO2能與強氧化劑Cl2反應生成SO2Cl2,為此進行探究.
某學習小組推測SO2能與強氧化劑Cl2反應生成SO2Cl2,為此進行探究.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳的電子式: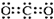 | B. | 14C的原子結構示意圖: | ||
| C. | C3H8的結構式CH3-CH2-CH3 | D. | 次氯酸的電子式: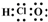 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 C的離子結構示意圖:
C的離子結構示意圖: .
.
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 反應:L(s)+aG(g)?bR(g) 達到平衡時,溫度和壓強對該反應的影響如圖所示:圖中壓強p1>p2,x軸表示溫度,y軸表示平衡混合氣中G的體積分數.
反應:L(s)+aG(g)?bR(g) 達到平衡時,溫度和壓強對該反應的影響如圖所示:圖中壓強p1>p2,x軸表示溫度,y軸表示平衡混合氣中G的體積分數.| A. | a<b | B. | 上述反應是吸熱反應 | ||
| C. | a>b | D. | 上述反應是放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
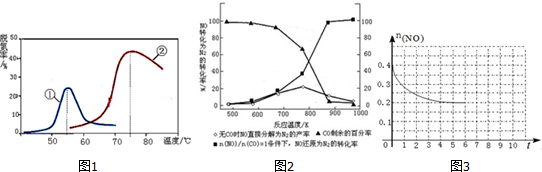
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
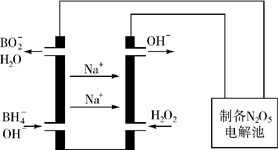 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸鹽等,在生產、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸鹽等,在生產、生活中具有重要作用.| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 晶體硅常用作半導體材料 | B. | 二氧化硅不能與任何酸反應 | ||
| C. | 硅在地殼中主要以化合態形式存在 | D. | 硅酸可通過硅酸鈉與鹽酸反應制得 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 比較去銹的鐵釘和去銹的繞有細銅絲的鐵釘與同濃度的鹽酸反應速率快慢時,可以加K3[Fe(CN)6]溶液,觀察鐵釘周圍出現藍色沉淀的快慢 | |
| B. | 將在空氣中灼燒呈黑色的銅絲趁熱插入盛有乙醇的試管中,銅絲變紅色;反復數次,試管中的液體出現刺激性氣味,表明乙醇已被銅氧化為乙醛 | |
| C. | 欲粗略測定某未知濃度的醋酸溶液中醋酸的電離常數Ka,應做的實驗和所需的試劑(或試紙)為:中和滴定實驗、pH試紙 | |
| D. | 從海帶中提取碘,可將灰化后的海帶加入水中煮沸一段時間后過濾,向濾液中滴入幾滴硫酸,再加入適量H2O2溶液氧化,最后加入CCl4萃取分離 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com