
 鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質可以自由遷移,正極反應式為:MnO2+Li++e-=LiMnO2.回答下列問題:
鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質可以自由遷移,正極反應式為:MnO2+Li++e-=LiMnO2.回答下列問題:分析 形成原電池反應時,Li為負極,被氧化,電極方程式為Li-e-=Li+,MnO2為正極,被還原,電極方程式為MnO2+e-+Li+=LiMnO2,結合電極方程式以及元素化合價的變化解答該題.
解答 解:(1)Li為負極,MnO2為正極,原電池工作時,外電路的電流方向從正極到負極,即從b極流向a極,電子移動方向與電流相反,由a流向b,
故答案為:a;b;
(2)Li為負極,被氧化,電極方程式為Li-e-=Li+,故答案為:Li-e-=Li+;
(3)14gLi為2mol,2molLi反應轉移電子物質的量為2mol,電解水時,每有2mol電子轉移生成1mol氫氣,在標準狀況下體積為22.4L,故答案為:22.4;
(4)MnO2可與KOH和KClO3在高溫下反應,生成K2MnO4,反應的方程式為3MnO2+KClO3+6KOH$\frac{\underline{\;高溫\;}}{\;}$3K2MnO4+KCl+3H2O,
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,反應中Mn元素化合價分別由+6價升高到7價、降低到+4價,由氧化還原反應氧化劑和還原劑之間得失電子數目相等可知,生成KMnO4和MnO2的物質的量之比為2:1,
故答案為:3MnO2+KClO3+6KOH$\frac{\underline{\;高溫\;}}{\;}$3K2MnO4+KCl+3H2O;2:1.
點評 本題側重于電化學知識以及氧化還原反應的全面考查,題目難度適中,能很好地考查學生的分析能力、計算能力以及電化學知識的綜合理解和運用,難度中等.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | Q中只有離子鍵 | |
| B. | 原子半徑W>Z>Y>X | |
| C. | Y元素可形成兩種含氧酸,且這兩種含氧酸均為強酸 | |
| D. | 最簡單氫化物的穩定性Z>Y>X,沸點Z>Y>X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用惰性電極電解飽和氯化鈉溶液:2Cl-+2H+ $\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈堿性:HS-+H3O+?H2S+H2O | |
| C. | 過量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入過量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
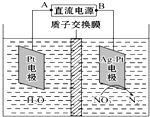
| A. | A為電源的正極 | |
| B. | 溶液中H+從陽極向陰極遷移 | |
| C. | 陰極反應式為2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若電解過程中轉移了2 mol電子,則左側電解液的質量減少了16g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 實驗Ⅰ:酸性KMnO4溶液中出現氣泡,且顏色逐漸褪去 | |
| B. | 實驗Ⅱ:中和熱測定 | |
| C. | 實驗Ⅲ:可用來制取并收集NO2 | |
| D. | 實驗Ⅳ:可用于HCl氣體的吸收 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | R在周期表的第15列 | |
| B. | Y、Q兩種元素的氣態氫化物的熱穩定性:HQ>HY | |
| C. | 簡單離子的半徑:X>Z>M | |
| D. | Z的單質能從M與Q元素構成的鹽溶液中置換出單質M |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分離、提純→確定分子式→確定實驗式→確定結構式 | |
| B. | 分離、提純→確定實驗式→確定分子式→確定結構式 | |
| C. | 分離、提純→確定結構式→確定實驗式→確定分子式 | |
| D. | 確定分子式→確定實驗式→確定結構式→分離、提純 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com