
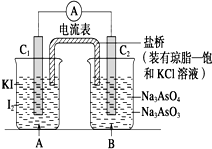
 已知反應AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反應.設計如圖裝置
已知反應AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反應.設計如圖裝置| A. | 操作Ⅰ過程中,C1為正極 | |
| B. | 操作Ⅱ過程中,鹽橋中的K+移向B燒杯溶液 | |
| C. | Ⅰ操作過程中,C2棒上發生的反應為AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作過程中,C1棒上發生的反應為2I--2e-=I2 |
分析 由圖可知,該裝置為原電池,Ⅰ、發生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒為負極;Ⅱ、發生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒為負極,電子由負極流向正極;
A、操作Ⅰ中發生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒為負極;
B、操作II過程中發生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒為負極,電子由負極流向正極,鹽橋中的鉀離子向A燒杯移動;
C、I操作過程中發生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒為負極,發生2I--2e-=I2,C2為正極發生還原反應;
D、AsO32-和I2在水溶液中可以發生自發的氧化還原反應,在原電池的正極上發生得電子的還原反應,負極上失電子發生氧化反應,根據氧化還原反應的生成物來確定現象以及電極方程式.
解答 解:A、操作Ⅰ中發生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒為負極,故A錯誤;
B、操作II過程中發生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒為負極,電子由負極流向正極,鹽橋中的鉀離子向A燒杯移動,故B錯誤;
C、I操作過程中發生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒為負極,發生2I--2e-=I2,C2為正極發生還原反應,電極反應為AsO42-+2H++2e-=AsO32-+H2O,故C正確;
D、II操作過程中當向B中加入NaOH溶液時,反應AsO43-+2I-+2H+?AsO33-+I2+H2O,逆向進行,C2棒為負極失電子發生電極反應為AsO33-+H2O-2e-=AsO43-+2H+,C1為正極,電極反應為,I2+2e-=2I-,故D錯誤;
故選C.
點評 本題考查電解池和原電池,明確電解質的不同發生的電池反應不同是解答本題的關鍵,并熟悉原電池和電解池的工作原理來解答即可,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 先生成白色沉淀,加入足量氨水后沉淀消失 | |
| B. | 生成的沉淀為AgCl,它不溶于水,但溶于氨水,重新電離成Ag+和Cl- | |
| C. | 生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl | |
| D. | 若向AgNO3溶液中直接滴加氨水,產生的現象也是先出現白色沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述灼燒過程的尾氣回收后可用來制硫酸 | |
| B. | 上述過程中,由6 mol CuFeS2制取6 mol Cu時共消耗15 mol O2 | |
| C. | 在反應2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化劑 | |
| D. | 1200℃灼燒Cu2S得Cu2O而不是CuO,可能是高溫下+1價銅更穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol Cl2參加反應轉移電子數一定為2NA | |
| B. | 在反應KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2轉移的電子數為6NA | |
| C. | 根據反應中HNO3(稀)$\stackrel{被還原}{→}$NO,而HNO3(濃)$\stackrel{被還原}{→}$NO2可知,氧化性HNO3(稀)>HNO3(濃) | |
| D. | 含有大量NO3-的溶液中,不能同時大量存在H+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在晶體硅中,Si原子與Si-Si鍵數目比為1:2 | |
| B. | 分子晶體中都存在范德華力,分子內都存在共價鍵 | |
| C. | HF、HCl、HBr、HI四種物質的沸點依次升高 | |
| D. | 干冰和氯化銨分別受熱變為氣體所克服的粒子間相互作用屬于同種類型 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com