
| 反應時間 | t0 | t1 | t2 | t3 |
| 燒杯和藥品的質量/g | 166.5 | 166.3 | 166.1 | 166.1 |
分析 (1)由已知:“用質量相等的鎂粉和鋁粉,分別與溶質質量分數相同、等質量的稀鹽酸充分反應”,若酸完全反應,金屬都剩余,則生成氫氣相等,若金屬完全反應,則生成氫氣一定不相等.
(2)回顧一氧化碳還原氯化鐵的實驗,回答對該實驗的操作所提出的問題.
(3)由表中的實驗數據可判斷第四次稱量時已完全反應,利用質量守恒定律,可計算放出氫氣的質量;
根據化學方程式求出鐵的質量,進而求出①.
解答 解:(1)根據化學方程式:Mg+2HCl=MgCl2+H2↑;2Al+6HCl═2AlCl3+3H2↑進行計算可知:
A、因為鎂的活動性比鋁的活動性強,鎂反應速度快,故A說法正確;
B、如果鹽酸均反應完,鎂恰好完全反應,鋁有剩余,故B說法正確;
C、如果鎂、鋁都反應完,則產生的氫氣一定不等,說法不正確.
D、鹽酸均反應完,鎂、鋁都反應完,生成的氫氣一定相等,故D說法正確;
故選AB
(2)一氧化碳還原氧化鐵生成鐵和二氧化碳,故看到的現象為固體由紅變黑,澄清石灰水變渾濁,為防止生成的鐵被氧化,實驗結束前還要繼續通一氧化碳直到冷卻,故不需要斷開;
(3)由質量守恒定律可知,生成氫氣的質量=反應前總質量一反應后總質量=11.5+100g+55g-166.1g=0.4g
設鐵的質量為x
Fe+H2SO4 =FeSO4 +H2↑;
56 2
x 0.4g
$\frac{56}{x}=\frac{2}{0.4g}$
解得:x=11.2g
原生鐵樣品中鐵的質量分數=$\frac{11.2g}{11.5g}$×100%=97.4%
故答案為:(1)AB;
(2)①A 固體由紅變黑,B 石灰水變渾濁,②不需要,氣體會一直通到裝置冷卻,不會發生倒吸;
(3)①0.4;②原生鐵樣品中鐵的質量分數是97.4%.
點評 本題為涉及較多的化學基礎知識,題目難點不大但涉及面較廣,耐心審題、沉著作答對于解答類似問題會有較大幫助.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 將50.0mL酒精與50.0mL蒸餾水混合,所得溶液體積小于100.0mL | |
| B. | 鐵絲在氧氣中燃燒,劇烈燃燒、火星四射、放熱,生成四氧化三鐵 | |
| C. | “粗鹽提純”實驗中,過濾時將懸濁液直接倒入漏斗 | |
| D. | 硫在空氣中燃燒發出明亮藍紫色火焰,生成無色無味氣體 |
查看答案和解析>>
科目:初中化學 來源: 題型:多選題
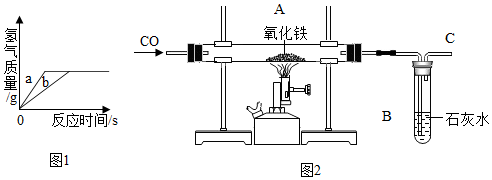
| A. | 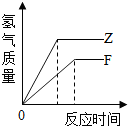 表示向足量的稀HCl中加入等質量的鋅和鐵,生成氫氣質量和反應時間的關系圖 | |
| B. | 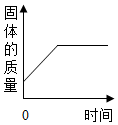 表示CO還原Fe2O3的實驗中,試管內的固體質量與時間的關系圖 | |
| C. | 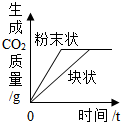 表示等質量CaCO3分別與等體積等質量分數的稀鹽酸(足量)反應 | |
| D. |  表示向足量的稀HCl中加入少量Fe,溶液質量與時間的關系圖 |
查看答案和解析>>
科目:初中化學 來源: 題型:多選題
| 物質 | 甲烷 | 氧氣 | 水 | 二氧化碳 | X |
| 反應前質量/g | 3.2 | 11.2 | 0 | 0 | 0 |
| 反應后質量/g | 0 | 0 | 7.2 | 4.4 | a |
| A. | 表中a的值為2.8 | B. | X一定是該反應的催化劑 | ||
| C. | X可能含有氫元素 | D. | X一定含有氧元素 |
查看答案和解析>>
科目:初中化學 來源:2017屆湖北省襄陽市保康縣九年級中考適應性考試化學試卷(解析版) 題型:信息分析題
分析、歸納、總結是學習化學的有效方法.
(1)用“三”總結化學知識如下:
①復分解反應發生的三個條件是:生成沉淀或生成________________或生成水;
②燃燒的三個條件是有可燃物、氧氣(或空氣)和_______________.
③鐵生銹的三種反應物質是:鐵、水和___________;
(2)在C + 2CuO 2Cu + CO2↑與CO + CuO
2Cu + CO2↑與CO + CuO  Cu + CO2兩個反應中,C和CO都是將CuO還原為Cu的物質,故在該反應中作還原劑.
Cu + CO2兩個反應中,C和CO都是將CuO還原為Cu的物質,故在該反應中作還原劑.
①上述兩個反應中還原劑的化合價變化規律:_______________.
②根據你的規律,判斷反應Fe+H2SO4=FeSO4+H2↑中的還原劑是_______________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com