
 為測定鋅銅合金中鋅的含量,取該合金放入如圖 盛有稀硫酸的錐形瓶中,多次實驗后,取平均值所得數據如下表:
為測定鋅銅合金中鋅的含量,取該合金放入如圖 盛有稀硫酸的錐形瓶中,多次實驗后,取平均值所得數據如下表:| 反應前 | 充分反應后裝置及反應剩余物質質量 | |
| 裝置和足量的稀硫酸質量 | 鋅銅合金質量 | |
| 342.10g | 16.00 | 357.70g |
分析 銅不能和稀硫酸反應,鋅和稀硫酸反應生成硫酸鋅和氫氣,反應前后的質量差即為反應生成氫氣的質量,根據氫氣的質量可以計算鋅的質量,進一步可以計算該合金中鋅的質量分數.
解答 解:(1)設鋅的質量為x,
反應生成氫氣的質量為:342.10g+16.00g-357.70g=0.4g,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.4g
$\frac{65}{x}$=$\frac{2}{0.4g}$,
x=13g,
該合金中鋅的質量分數為:$\frac{13g}{16.00g}$×100%=81.25%,
答:該合金中鋅的質量分數為81.25%.
(2)如沒有干燥裝置,部分水蒸氣會隨著氫氣逸出,導致計算結果會偏大.
故填:偏大.
點評 計算生成氫氣的質量時利用了差量法,差量法在計算中的應用很廣泛,解答的關鍵是要分析出物質的質量差與要求的未知數之間的關系,再根據具體的數據求解.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
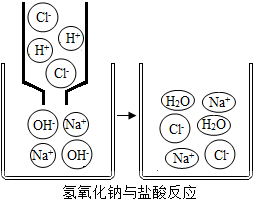 今有①肥皂水 ②食鹽水 ③楊梅汁 ④白糖水 ⑤蒸餾水,5種液體,根據你的生活經驗判斷,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序號).右圖是氫氧化鈉與鹽酸反應的微觀示意圖,請仔細觀察、分析此圖,寫出一條你從圖中獲取的信息(用文字或化學用語表述)氫氧化鈉與鹽酸反應的實質是氫離子與氫氧根離子反應生成水.
今有①肥皂水 ②食鹽水 ③楊梅汁 ④白糖水 ⑤蒸餾水,5種液體,根據你的生活經驗判斷,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序號).右圖是氫氧化鈉與鹽酸反應的微觀示意圖,請仔細觀察、分析此圖,寫出一條你從圖中獲取的信息(用文字或化學用語表述)氫氧化鈉與鹽酸反應的實質是氫離子與氫氧根離子反應生成水.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com